
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH >7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol/L NaOH标准溶液滴定HCI与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水②0.1mol/L盐酸③0.1 mol/L氯化镁溶液④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.常温下,呈碱性的溶液:K+、AlO2-、CO32-、Na+ |
| B.含Fe3+的溶液中:K+、NH4+、Cl-、I- |
| C.中性溶液:Fe3+、Al3+、NO3-、SO42- |
| D.无色溶液中:K+、AlO2-、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.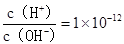 的溶液:K+、Cl-、SO32-、SiO32- 的溶液:K+、Cl-、SO32-、SiO32- |
| B.空气中:CO2、NO、SO2、CH4 |
| C.氢氧化铝胶体中:Cl-、HClO、Na+、SO32- |
| D.加入铝粉放出大量氢气的溶液:Fe2+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- |
| B.C(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br- |
| C.CO32-可以大量共存的溶液:Na+、K+、NO3-、Al3+ |
| D.由水电离的c(H+)=1.0×10-13 mol·L-1的溶液中:K+、NH4+、AlO2-、HCO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲基橙呈红色的溶液中:I-、Cl-、NO3-、Na+ |
| B.石蕊呈蓝色的溶液中:Na+、AlO2-、NO3-、HCO3- |
| C.含大量Al3+的溶液中:K+、Na+、NO3-、ClO- |
| D.含大量OH一的溶液中:CO32-、Cl-、F-、K+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaOH溶液:Fe3+、SO2—4、HCO—3 |
| B.Na2SiO3溶液:S2—、SO2—3、Cl— |
| C.乙酸溶液:NH+4、NO—3、CO2—3 |
| D.酸性高锰酸钾溶液:Al3+、I—、SO2—4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4种溶液pH的大小顺序:①>④>③>② |
| B.等体积的①和②溶液混合后pH>7,c(NH3·H2O)>c( NH4+) |
| C.溶液①、③由水电离产生的c(OH― ):①<③ |
| D.溶液③、④等体积混合后,溶液中c(CO32-)>c(HCO3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na+、K+、AlO2-、CO32- | B.Fe2+、Na+、SO42-、NO3- |
| C.Mg2+、NH4+、CO32-、Cl- | D.Ba2+、K+、Cl-、MnO4- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
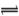 X2—+H+。回答下列问题:
X2—+H+。回答下列问题: (2)在25℃下,向浓度均为0.1 mol·L—1的FeCl3和AlCl3混合溶液中逐滴加入氨水,先生成 (填化学式)沉淀。已知25℃时Ksp[Fe(OH)3]=2.6×10—39 mol4·L—4,KsP[Al(OH)3]=1.3×10—33 mol4·L—4。
(2)在25℃下,向浓度均为0.1 mol·L—1的FeCl3和AlCl3混合溶液中逐滴加入氨水,先生成 (填化学式)沉淀。已知25℃时Ksp[Fe(OH)3]=2.6×10—39 mol4·L—4,KsP[Al(OH)3]=1.3×10—33 mol4·L—4。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com