
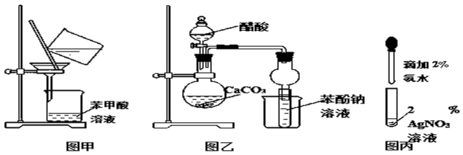
分析 (1)由图甲可知为过滤装置,除去不溶性杂质;
(2)证明醋酸、碳酸、苯酚酸性的相对强弱,发生强酸制取弱酸的反应,试管中二氧化碳与苯酚钠反应生成苯酚沉淀,醋酸易挥发,据此分析;
(3)配制银氨溶液,氨水滴加到硝酸银溶液中,先生成白色沉淀,后沉淀恰好溶解,银镜反应在碱性条件下水浴加热发生,乙醛与银氨溶液反应生成乙酸铵、Ag、氨气和水.
解答 解:(1)由图甲可知为过滤装置,可以除去粗苯甲酸中所含的不溶性(或难溶于水的)杂质,故答案为:过滤;不溶性(或难溶于水的);
(2)证明醋酸、碳酸、苯酚酸性的相对强弱,发生强酸制取弱酸的反应,试管中二氧化碳与苯酚钠反应生成苯酚沉淀,实验现象是溶液变浑浊,醋酸易挥发,生成的二氧化碳中含有醋酸,该实验中存在的缺陷是未除去CO2中混有的CH3COOH,
故答案为:溶液变浑浊;CO2;CH3COOH;
(3)配制银氨溶液过程中,试管内发生变化的现象是溶液先变浑浊(或产生大量白色沉淀),继续滴入氨水溶液又变澄清.配好银氨溶液后,向其中加入乙醛进行银镜反应时,为了获得良好的实验效果,对试管采用的加热方式是热水浴加热.乙醛发生银镜反应的化学方程式是CH3CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH3COONH4+2Ag↓+3NH3↑+H2O,
故答案为:溶液先变浑浊(或产生大量白色沉淀),继续滴入氨水溶液又变澄清;热水浴加热;CH3CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH3COONH4+2Ag↓+3NH3↑+H2O.
点评 本题考查性质实验的设计及实验装置的作用,为高频考点,把握物质的性质、实验原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验技能应用,题目难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:实验题
| 实验 | 向试管中加入2ml溶液 | 实验现象 |
 | 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 60s:反应进一步加快且反应剧烈放热,液体几乎沸腾 120s:铝片反应完,试管中析出大量蓬松的红色物质 |
| 实验Ⅱ:0.5mol/LCuSO4溶液 | 15s 无明显现象 60s:铝片表面有极少气泡 120s:有少量气泡溢出,铝片边缘有很少红色物质生成 |
| 实验 | 向试管中加入2mL溶液 | 实验现象 |
 | 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
| 实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
| 实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
| 实验Ⅵ:0.5mol/LCuSO4溶液+0.02mol NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
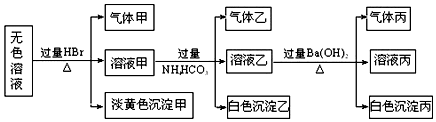
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
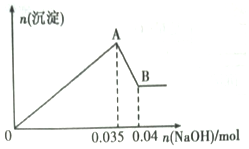 某无色工业废水中可能含有Na+、Mg2+、Al3+、Cu2+、Cl-、SO42-中的几种离子.
某无色工业废水中可能含有Na+、Mg2+、Al3+、Cu2+、Cl-、SO42-中的几种离子.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| ① | ||||||
| ② | ③ | ④ | ||||
| ⑤ | ⑥ | ⑦ | ⑧ |
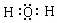 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{18}$O与${\;}_{8}^{16}$O是中子数相同 | B. | ${\;}_{8}^{18}$O与${\;}_{8}^{16}$O互为同位素 | ||
| C. | ${\;}_{8}^{18}$O和${\;}_{8}^{16}$O化学性质不相同 | D. | ${\;}_{8}^{18}$O和${\;}_{8}^{16}$O互为同素异形休 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 熔点/℃ | 2 852 | 2 072 | 714 | 190(2.5×105 Pa) |
| 沸点/℃ | 3 600 | 2 980 | 1 412 | 182.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com