
【题目】常温下,在溶液中可发生以下反应:
①2Fe2++Br2![]() 2Fe3++2Br-,②2Br-+Cl2
2Fe3++2Br-,②2Br-+Cl2![]() Br2+2Cl-,③2Fe3++2I-
Br2+2Cl-,③2Fe3++2I-![]() 2Fe2++I2。
2Fe2++I2。
由此判断下列说法错误的是
A. 氧化性强弱顺序为:Cl2>Br2>Fe3+>I2
B. 反应②中当有1 mol Cl2被还原时,有2mol Br-被氧化
C. 铁元素在反应①和③中均被氧化
D. 还原性强弱顺序为:I->Fe2+>Br->Cl-
【答案】C
【解析】
A.反应2Fe2++Br2=2Fe3++2Br-中Fe2+被单质溴氧化为Fe3+,反应2Br-+Cl2=Br2+2Cl-中溴离子被氯气氧化为单质溴,反应2Fe3++2I-=2Fe2++I2中I-被Fe3+氧化为I2,根据氧化剂的氧化性强于氧化产物的氧化性可知氧化性强弱顺序为Cl2>Br2>Fe3+>I2,A正确;
B.反应2Br-+Cl2=Br2+2Cl-中,当有1 mol Cl2被还原时,有2 mol Br-被氧化,B正确;
C.反应①中铁元素被氧化,反应③中铁元素被还原,C错误;
D、根据还原剂的还原性强于还原产物的还原性可知还原性强弱顺序为:I->Fe2+>Br->Cl-,D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】室温下,向0.01 mol·L-1 的醋酸溶液中滴入pH=7 的醋酸铵溶液,溶液pH 随滴入醋酸铵溶液体积变化的曲线示意图如图所示。下列分析正确的是

A. a 点,pH = 2
B. b 点,c(CH3COO-) > c(NH4+)
C. c 点,pH 可能大于 7
D. ac 段,溶液pH 增大是CH3COOH 受醋酸铵的影响而不再电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了能观察到丁达尔效应,一中鼹鼠科学社的同学在实验室制备Fe(OH)3胶体。
(1)胶体与其他分散系的本质区别是:__。
(2)制备时,将_逐滴滴加至_中,待液体呈_后,停止加热;反应方程式为__。
(3)有一种橘红色的硫化锑(Sb2S3)胶体,装入U型管,插入电极后通直流电,发现阳极附近橘红色加深,这叫__现象,证明Sb2S3胶粒带__电荷。
(4)如何设计实验验证制得的氢氧化铁是胶体:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
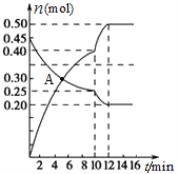
①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.化学是一门以实验为基础的学科,化学所取得的丰硕成果与实验的重要作用分不开。结合下列实验装置图回答问题:

(1)写出上述图中仪器的名称:①_______;②____。
(2)若利用装置I分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的玻璃仪器有________,将仪器补充完整后进行的实验操作的名称为_______;实验时仪器②中冷却水的进口为____(填“f”或 “g”),蒸馏烧瓶内碎瓷片的作用是________。
(3)现需配制250 mL 0.1 moI.L-1NaCl溶液,装置II是某同学转移溶液的示意图,图中有两处错误分别是________,________。
II. ①海带等藻类物质经过处理后,可以得到碘水,向碘水中加入四氯化碳以提取碘单质的实验操作叫________,该操作需要的玻璃仪器有________。
②某NaCl样品中可能含有SO42-,CO32-,为检验杂质离子的存在,采取如下实验步骤:
样品![]() 无明显现象
无明显现象![]() 无明显现象。
无明显现象。
则加入的试剂A为_______,B为_______,该现象证明样品中不含有____。
③在后续实验中需要使用450mL0.5 mol·L- 1NaCl溶液,为配制该浓度NaCl溶液进行实验,需用托盘天平称取NaCl_______g。配制NaCl溶液时,若出现下列操作,会使配制浓度偏高的是____________
A.天平砝码己锈蚀 B.配制过程中未用蒸馏水洗涤烧杯和玻璃棒
C.转移溶液时有溶液溅出 D.定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以C8H10、C3H6为原料生产有机玻璃 PMMA 的单体,同时还可以得到高分子材料 PET 聚酚树脂的单体。 合成路线如下(部分反应条件及产物略去):
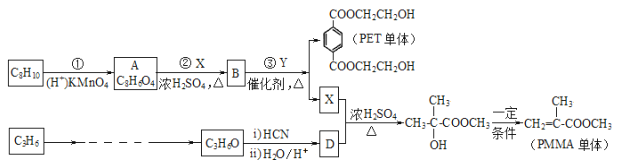
已知: I.RCOOR′+R″OH![]() RCOOR″+R′OH(R、R′、R″均代表烃基)
RCOOR″+R′OH(R、R′、R″均代表烃基)
II.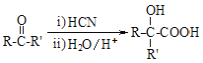
请回答下列问题:
(1)化合物 A 的官能团名称__________, ③的反应类型_____________。
(2)反应②的化学方程式_______________________________。
(3)写出符合下列要求,与 PMMA 单体互为同分异构体的所有同分异构体的结构简式是___________。
①红外光谱(IR)证明分子结构中有碳碳双键;
②1H 核磁共振谱(1H-NMR)显示有四种不同的氢原子。
③能与碳酸氢钠反应产生气体;
(4)Y 的结构简式_________________。
(5)写出 C3H6 到 C3H6O 的合成路线(试剂及溶剂任选;合成路线参照“已知 II”中的书写形式)
_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有CO、N2、H2、CO2和少量水蒸气的混合气体,依次通过足量的灼热氧化铜、浓氢氧化钠溶液、浓硫酸后,剩余的气体是( )
A.N2
B.N2和H2
C.N2和CO2
D.H2和CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 铅蓄电池放电时负极质量减轻,充电时阳极质量增加
B. 同温下,0.1 mol·L-1醋酸溶液pH=a,0.01 mol·L-1醋酸溶液pH=b,则a+1<b
C. 钢铁水闸可用牺牲阳极的阴极保护法或外加电流的阴极保护法进行防护
D. 一定条件下反应N2+3H2![]() 2NH3,当3v正(H2)=2v逆(NH3),则反应达到平衡
2NH3,当3v正(H2)=2v逆(NH3),则反应达到平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com