
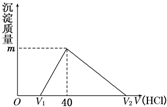
 将一定量的钠铝合金置于水中,合金全部溶解,得到20mL OH-浓度为1mol/L的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是
将一定量的钠铝合金置于水中,合金全部溶解,得到20mL OH-浓度为1mol/L的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是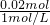 =0.02L=20mL,
=0.02L=20mL,

科目:高中化学 来源: 题型:单选题
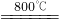 Cu2S+3SO2+2FeO
Cu2S+3SO2+2FeO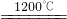 2Cu2O+2SO2
2Cu2O+2SO2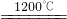 6Cu+SO2↑
6Cu+SO2↑查看答案和解析>>
科目:高中化学 来源: 题型:解答题
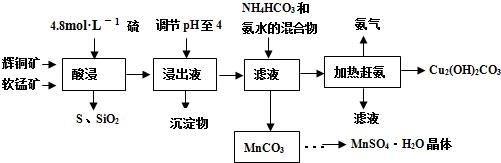
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
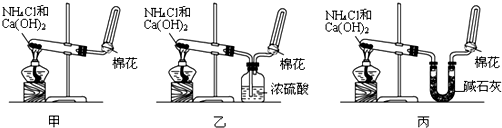
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
 -O-+CO2+H2O→
-O-+CO2+H2O→ -OH+HCO3-
-OH+HCO3-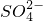 =BaSO4↓
=BaSO4↓查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com