
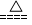 CaCl2 + 2NH3↑ + 2H2O
CaCl2 + 2NH3↑ + 2H2O

科目:高中化学 来源:不详 题型:单选题
| A.CO2、CCl4、CH4三个分子中所有原子都满足最外层8电子结构 |
| B.第ⅠA族的金属元素形成的单质的熔点随原子序数的递增而降低 |
| C.第ⅦA族元素形成的单质的熔点随原子序数的递增而降低 |
| D.第ⅠA族元素燃烧形成的氧化物中氧的化合价都不是-2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.砹是一种有色固体,它的气态氢化物很不稳定砹化银为有色沉淀且不溶解于稀硝酸,很容易分解 |
| B.在周期表中金属和非金属元素的分界线附近可以寻找半导体材料 |
| C.铷的硫酸盐易溶解于水,其氢氧化物一定是强碱 |
| D.溴化氢没有氯化氢稳定,其水溶液的酸性是盐酸>氢溴酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
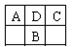
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X可能是第二周期非金属元素 | B.X可能是第三周期金属元素 |
| C.Y可能与X同主族 | D.Y一定是金属元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

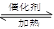 N2+H2O(方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是 L。
N2+H2O(方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是 L。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②⑤ | C.①②③④⑤ | D.全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com