
分析 有镁、铝和铁的混合物6.7g,与足量烧碱溶液共热后,只有Al与氢氧化钠反应生成氢气,根据生成的氢气计算混合物中Al的物质的量;将剩余溶液过滤后,残渣为Mg、Fe,根据二者质量、电子转移守恒列方程计算Mg、Fe物质的量.
解答 解:有镁、铝和铁的混合物6.7g,与足量烧碱溶液共热后,只有Al与氢氧化钠反应生成氢气,生成氢气为$\frac{3.36L}{22.4L/mol}$=0.15mol,则Al的物质的量为$\frac{0.15mol×2}{3}$=0.1mol,
将剩余溶液过滤后,残渣为Mg、Fe,Al的质量为0.1mol×27g/mol=2.7g,则混合物中Mg、Fe总质量为6.7g-2.7g=4g,与硫酸反应生成氢气为$\frac{2.24L}{22.4L/mol}$=0.1mol,设Mg、Fe的物质的量分别为xmol、ymol,根据二者质量、电子转移守恒,则:$\left\{\begin{array}{l}{2x+2y=0.1×2}\\{24x+56y=4}\end{array}\right.$,解得x=y=0.05,
故混合物中Al的物质的量分数为$\frac{0.1mol}{(0.1+0.05+0.05)mol}$×100%=50%,
Mg、Fe的物质的量分数为$\frac{0.05mol}{(0.1+0.05+0.05)mol}$×100%=25%,
答:混合物中Al的物质的量分数为50%,Mg、Fe的物质的量分数均为25%.
点评 本题考查混合物有关计算,难度不大,注意利用电子转移守恒解答,避免方程式的繁琐.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
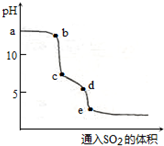 PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx.
PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中水电离出的c(H+)=10-10 mol•L-1 | |
| B. | 溶液中c(H+)+c(A-)=0.1 mol•L-1 | |
| C. | 与0.05 mol•L-1 NaOH溶液等体积混合,水的电离平衡向正向移动 | |
| D. | 上述溶液中加入一定量NaA晶体或加水稀释,溶液的c(OH-)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逆反应速率增大更大,平衡向逆反应方向移动 | |
| B. | 正反应速率增大更大,平衡向正反应方向移动 | |
| C. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 | |
| D. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn+2HCl═ZnCl2+H2↑ | B. | O2+4HCl═2Cl2+2H2O | ||
| C. | MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O | D. | 2HCl═Cl2+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
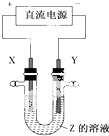 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )| A. | 外加电流的阴极保护法中,Y是待保护金属 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 电镀工业中,X是待镀金属,Y是镀层金属 | |
| D. | 氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 现象 | 单质B的相关性质(填序号) | 相关的化学方程式 | |
| Ⅰ | 单质B浮在水面上 | ||
| Ⅱ | 熔成一个小球 | ||
| Ⅲ | 四处游动,发出嘶嘶的声音 | ||
| Ⅳ | 滴入酚酞试剂,溶液变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com