
【题目】科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1mol/LZ的氢化物的水溶液pH=1,且Z与Y位于不同周期。下列叙述正确的是( )
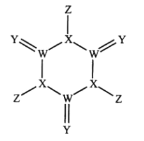
A.原子半径:Z>Y>X>W
B.氢化物的沸点:Y>X>Z>W
C.X的氧化物的水化物是强酸
D.Y的某种单质具有杀菌消毒作用
【答案】D
【解析】
由新型漂白剂的结构可知,W形成的价键数为4,X形成的价键数为3,Y形成的价键数为2,Z形成的价键数为1;W、X、Y、Z均为短周期元素且原子序数依次增大,常温下,0.1mol/LZ的氢化物的水溶液pH=1,则Z为Cl;Z与Y位于不同周期,则Y为O元素、W为C元素、X为N元素,据此分析解题。
由分析知:W为C元素、X为N元素、Y为O元素、Z为Cl元素;
A.C、N、O为同周期主族元素,核电荷数越大,原子半径越小,C、N、O、Cl四种元素的原子半径由大到小的顺序为Cl>C>N>O,即Z>W>X>Y,故A错误;
B.H2O常温下为液体,NH3和H2O分子间存在氢键,四种元素简单氢化物的沸点由高到低的顺序为H2O>NH3>HCl>CH4,但C的氢化物包括多碳的烃,常温下有固体,有液体,即碳的氢化物沸点也可能比H2O高,故B错误;
C.N的最高价氧化物的水化物HNO3是强酸,而+3价N的氧化物水化物HNO2是弱酸,故C错误;
D.O3具有强氧化性,具有杀菌消毒作用,故D正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】500 ℃条件下,在恒容密闭容器中,充入1 mol NO2存在如下平衡:2NO2(g) ![]() N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
A. 平衡向正反应方向移动 B. 平衡常数K增大
C. NO2的转化率变小 D. 容器内气体颜色先变深后变浅,最后比原来还要浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验。
(1)探究一包Na2O2样品是否已经变质:取少量样品,将其溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了m g样品,并设计用下图装置来测定过氧化钠的质量分数。

①装置中用于滴加盐酸的仪器的名称是_________,装置D的作用是_________________________________;
②将仪器连接好以后,必须进行的第一步操作是_________________________________;
③写出装置C中发生主要反应的化学方程式_________________________________;
④反应结束后,在读取实验中生成气体的体积时,你认为合理的是_______________(填序号);
a.读取气体体积前,需冷却到室温
b.调整量筒使E、F内液面高度相同
e.视线与凹液面的最低点相平时读取量筒中水的体积
⑤读出量筒内水的体积后,将其折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质均为常见物质或它们的溶液,其中 A为淡黄色固体, C、X 均为无色气体,Z为浅绿色溶液,D为一种常见的强碱,F物质不溶于水。根据它们之间的转化关系(下图),回答下列问题:
(部分反应物与产物已省略)
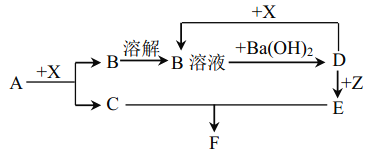
(1)写出下列物质的化学式:X____________ F______________
(2)向Z 溶液中通入足量的Cl2,写出检验所得溶液中阳离子所需试剂_______________________。
(3)向含 10g D 的溶液中通入一定量的 X,完全反应后,在低温条件下蒸发结晶,最终得到 14.8g 固体。
①简述蒸发结晶在低温条件下进行的理由:____________________________________________________(用必要的文字回答)
②所得固体中含有的物质及其它们的物质的量之比为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度为0.1mol·L-1、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
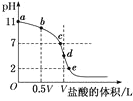
(1)该温度时NH3·H2O的电离常数K=__;
(2)比较b、c、d三点时的溶液中,由水电离出的OH-浓度大小顺序为__;
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的是__(填字母,下同);
A.c(H+)·c(OH-) B.![]() C.
C.![]() D.
D.![]()
(4)根据以上滴定曲线,下列说法正确的是__;
A.点b所示溶液中:c(NH![]() )+c(H+)=c(OH-)+c(NH3·H2O)
)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH![]() )
)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH![]() )>c(OH-)
)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c(NH![]() )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=___,d点之后若继续加入盐酸至图像中的e点(此时不考虑NH4+水解的影响,忽略混合时溶液体积变化),则e点对应的横坐标为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请综合运用所学知识,填写下列空白:
(1)①中和热测定实验中,除了烧杯、温度计、泡沫塑料、泡沫塑料板外,还需要使用的仪器有_____。
②下列关于中和热的说法正确的是______
A.用稀硫酸和Ba(OH)2溶液代替盐酸与NaOH溶液进行中和热测定,如果准确操作,所测中和热数值可以相同
B.测定中和热时,为保证酸碱充分反应,应将碱溶液缓慢分次倒入酸溶液中,并充分搅拌
C.测定中和热时,温度计测量盐酸溶液的温度后,用蒸馏水洗净再测NaOH溶液温度,实验准确度更高
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等
(2)①某反应历程,假设体系的始态为S,终态为L,它们之间的变化用两段弧线(可以包含任意数目的中间步骤)连接如图所示,则△H1+△H2=______。
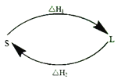
②已知C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=_______。
(3)①用如图所示装置,在一定条件下讨论锌与稀硫酸的反应速率时,采用一些方法测定了下列物理量,其中可以用于表示(或计算)其化学反应速率的是______
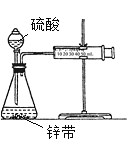
A.收集10mL H2所用的时间 B.一定时间内收集H2的体积
C.一定时间内溶液中H+的浓度变化 D.一定时间内锌粒质量的变化
E.一定时间内反应热量的变化
②为加快一定量的Zn与足量稀硫酸反应的速率,且不影响生成H2的总量,下列措施可行的是_____
A.加入少量CuSO4溶液 B.对反应液适当加热
C.将稀硫酸换成浓硫酸 D.将锌粒换成锌粉
(4)反应a M(g)+a N(g)![]() b W(g)+c Z(g),在体积相同且恒定的两个容器中,按照下列方式加入原料,一段时间后达到平衡:
b W(g)+c Z(g),在体积相同且恒定的两个容器中,按照下列方式加入原料,一段时间后达到平衡:
开始时 | 平衡时 | |||
容器1 | 2mol M | 1mol N | 总压P1 | 0.5mol W |
容器2 | 1mol M | 2mol N | 总压P2 | x mol W |
则x=____,P1_____P2(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家一直致力于“人工固氮”的新方法研究。
Ⅰ.目前合成氨技术原理为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1。
2NH3(g) △H=-92.4kJ·mol-1。
(1)在一定体积的容器中发生上述反应,下列描述中能说明该反应已达平衡的是______
A.容器内气体的平均摩尔质量保持不变
B.2v(NH3)正=v(N2)逆
C.容器中气体的压强保持不变
D.N2、H2、NH3的物质的量之比为1:2:3
(2)673K、30MPa下,向容积为2.0L的恒容密闭容器中充入0.80mol N2和1.60mol H2,反应3分钟达到平衡时,NH3的体积分数为20%。
①该条件下反应:N2(g)+3H2(g)![]() 2NH3(g)的平衡常数K=_____(精确到小数点后一位);K值越大,表明反应达到平衡时______
2NH3(g)的平衡常数K=_____(精确到小数点后一位);K值越大,表明反应达到平衡时______
A.H2的转化率一定越高 B.NH3的浓度一定越大
C.正反应进行得越完全 D.化学反应速率越大
②若达平衡后再向该容器中充入0.40mol N2和0.40mol NH3,该平衡将______(填“向正反应方向移动”、“向逆反应方向移动”或“不移动”)。
Ⅱ.根据“人工固氮”的最新研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
T/K | 303 | 313 | 323 |
NH3的生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(1)此合成反应的a_____0;ΔS______0,(填“>”、“<”或“=”)。
(2)已知(K为平衡常数):N2(g)+3H2(g)![]() 2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=______(用K1、K2表示)。
2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=______(用K1、K2表示)。
Ⅲ.已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(1) ΔH= -1316kJ·mol-1,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料,该燃料电池的负极反应式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是碳酸钙(CaCO3)在25 ℃和100 ℃两种情况下,在水中的溶解平衡曲线。下列有关说法正确的是
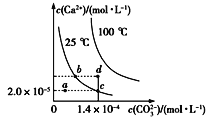
A. CaCO3(s)![]() Ca2+(aq)+ CO32-(aq) ΔH<0
Ca2+(aq)+ CO32-(aq) ΔH<0
B. a、b、c、d四点对应的溶度积Ksp相等
C. 温度不变,蒸发水,可使溶液由a点变到c点
D. 25 ℃时,CaCO3的Ksp=2.8×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系中有反应物和生成物共5种物质:H2S+HNO3→S+NO+H2O;下列说法中正确的是( )
A.该反应中的还原产物是S
B.若反应过程中转移了0.3 mol 电子,则氧化产物的质量9.6g
C.氧化剂与还原剂的物质的量之比为2∶3
D.反应后溶液的酸性明显增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com