
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、等pH的溶液物质的量浓度关系:C(NaCN)>C(Na2CO3)>C(CH3COONa) |
| B、amol/L HCN与b mol/LNaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b |
| C、相同体积相同浓度的NaCN 和CH3COONa溶液中,NaCN溶液的离子总数少 |
| D、HCN+CO32-→CN-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、69g | B、66g |
| C、85g | D、89g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgNO3 |
| B、NaCl |
| C、KOH |
| D、CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 方法一 | 石灰-石膏法:用石灰浆吸收SO2转化为石膏 |
| 方法二 | 碱发:用NaOH溶液吸收SO2转化为Na2SO3 |
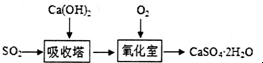 .
. .该法吸收快,效率高.若在操作中持续通入含SO2的烟气,则最终产物为
.该法吸收快,效率高.若在操作中持续通入含SO2的烟气,则最终产物为
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若无铜析出,则溶液中有Fe2+、Cu2+存在,Fe3+也可能存在 |
| B、若无铜析出,则溶液中有Fe2+、Cu2+存在,Fe3+不可能存在 |
| C、若有铜析出,则溶液中只有Fe2+,不可能有Cu2+、Fe3+存在 |
| D、若有铜析出,则溶液中有Fe2+存在,也可能有Cu2+,但无Fe3+存在. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲与乙处于同一周期 |
| B、甲与乙处同于同一主族 |
| C、甲与乙指的是碳和铝 |
| D、甲与乙的原子序数之和是偶数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com