
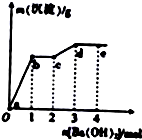
 向含有一定量盐酸和少量MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生沉淀的质量m克与加入Ba(OH)2的物质的量n之间的关系如图所示,下列说法正确的是( )
向含有一定量盐酸和少量MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生沉淀的质量m克与加入Ba(OH)2的物质的量n之间的关系如图所示,下列说法正确的是( )| A、a→b时的沉淀成分为BaSO4与Mg(OH)2 |
| B、原混合溶液中:n(HCl)=2mol |
| C、c点时的溶液中c(Cl-)>c(OH-)>c(Ba2+) |
| D、b→c时发生的离子反应为H++OH-=H2O |


科目:高中化学 来源: 题型:
| A、同一原子中,2p,3p,4p能级的轨道依次增多 |
| B、3p2表示3p能级有两个轨道 |
| C、同一原子中,1s,2s,3s电子的能量逐渐减小 |
| D、处于最低能量的原子叫做基态原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的氢化物溶于水生成弱酸 |
| B、Z的氢化物的水溶液在空气中存放不易变质 |
| C、Y与X可生成Y3X2型化合物 |
| D、Z的单质在氧气中燃烧可以生成两种酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
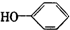 合成
合成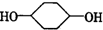 (部分试剂和反应条件已去).
(部分试剂和反应条件已去).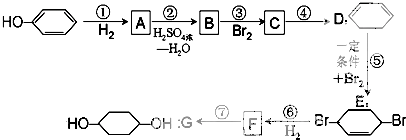
 ,写出在同条件CH2=CH-CH=CH2与等物质的量Br2发生加成反应的化学方程式:
,写出在同条件CH2=CH-CH=CH2与等物质的量Br2发生加成反应的化学方程式: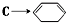 的化学方程式(有机物写结构简式,注明条件).
的化学方程式(有机物写结构简式,注明条件).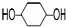 B.
B.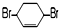 C.
C.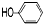
查看答案和解析>>
科目:高中化学 来源: 题型:
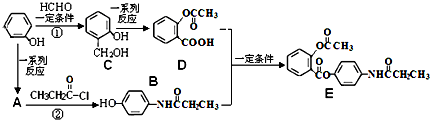
 ,请填写下列空格:
,请填写下列空格:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2g | B、4g |
| C、10g | D、12g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
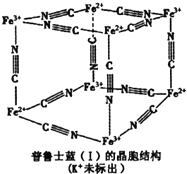 物质中铁含量的测定方法是多种多样的.
物质中铁含量的测定方法是多种多样的.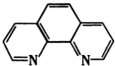 )结合显橙红色,再用比色法测定.其中涉及以下反应:4FeCl3+2NH2OH?HCl═4FeCl2+N2O↑+6HCI+H2O
)结合显橙红色,再用比色法测定.其中涉及以下反应:4FeCl3+2NH2OH?HCl═4FeCl2+N2O↑+6HCI+H2O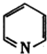 和邻啡罗啉都是含氮的有机物,l mol吡啶中含有Q键的物质的量为
和邻啡罗啉都是含氮的有机物,l mol吡啶中含有Q键的物质的量为查看答案和解析>>
科目:高中化学 来源: 题型:
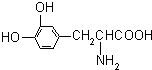 L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如图:
L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如图:| A、既没有酸性,又没有碱性 |
| B、既具有酸性,又具有碱性 |
| C、只有酸性,没有碱性 |
| D、只有碱性,没有酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com