
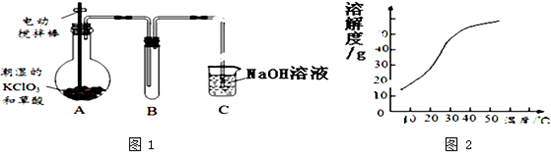
分析 (1)A中的反应为加热60℃,氯酸钾和草酸反应生成碳酸钾、二氧化碳、二氧化氯和水;
(2)二氧化氯(ClO2)制取温度是60℃,A需要温度控制(如水浴加热)装置,二氧化氯的沸点低,B装置应降低温度;
(3)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法;
(4)①多次实验可以减少误差,滴定至终点时,溶液中的碘恰好完全反应,原溶液中有淀粉和碘,当碘反应完全后溶液的蓝色褪去;
②根据关系式2ClO2~5I2~10Na2S2O3计算c(ClO2).
解答 解:(1)加热60℃,氯酸钾和草酸反应生成碳酸钾、二氧化碳、二氧化氯和水,反应方程式为2KClO3+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$K2CO3+CO2↑+2ClO2↑+H2O,
故答案为:2KClO3+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$K2CO3+CO2↑+2ClO2↑+H2O;
(2)二氧化氯(ClO2)制取温度是60℃,A需要温度控制(如水浴加热)装置,需要温度计,二氧化氯的沸点低,B装置应降低温度,补充冷凝装置,
故答案为:温度计;冰水浴;
(3)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,应趁热过滤,故答案为:蒸发结晶;
(4)①为减少实验误差,应采用多次实验的方法,滴定至终点时,溶液中的碘恰好完全反应,原溶液中有淀粉和碘,当碘反应完全后溶液的蓝色褪去,所以滴定终点的现象是溶液由蓝色变为无色,
故答案为:减小实验误差;溶液由蓝色变为无色;
②设原ClO2溶液的浓度为x,
2ClO2~5I2~10Na2S2O3
2mol 10mol
$\frac{10{\;}^{-2}x×V{\;}_{1}×10{\;}^{-3}}{10{\;}^{-1}}$ 1×10-3cV2mol
x=$\frac{2cV{\;}_{2}}{{V}_{1}}$=$\frac{135C{V}_{2}}{{V}_{1}}$g/L,
故答案为:$\frac{135C{V}_{2}}{{V}_{1}}$.
点评 本题考查实验方案的设计,同时考查学生分析问题、解决问题的能力,明确物质的性质是解本题关键,难度较大.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
一种三室微生物燃料电池污水净化系统原理如右图所示,图中有机废水中有机物可用C6H10O5表示。下列有关说法正确的是

A.b电极为该电池的负极
B.b电极附近溶液的pH减小
C.a电极反应式:C6H10O5-24e-+7H2O===6CO2↑+24H+
D.中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如图:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如图:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶[来 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 草酸是一种重要的化工原料,常用于有机合成,它属于二元弱酸,易溶于乙醇、水、微溶于乙醚.以甘蔗碎渣(主要成分为纤维素)为原料制取草酸的工艺流程如下:
草酸是一种重要的化工原料,常用于有机合成,它属于二元弱酸,易溶于乙醇、水、微溶于乙醚.以甘蔗碎渣(主要成分为纤维素)为原料制取草酸的工艺流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com