
100mL 0.3mol/L Na2SO4溶液和50mL 0.2mol/L Al2(SO4)3溶液混合后,溶液中SO42﹣的物质的量浓度约为()
A. 0.20mol/L B. 0.25mol/L C. 0.4mol/L D. 0.5mol/L
考点: 物质的量浓度的相关计算.
专题: 物质的量浓度和溶解度专题.
分析: 分别计算100mL 0.3mol/L Na2SO4溶液和50mL 0.2mol/L Al2(SO4)3溶液的SO42﹣的物质的量,总物质的量除以溶液的总体积即得溶液中SO42﹣的物质的量浓度.
解答: 解:100mL 0.3mol/L Na2SO4溶液中SO42﹣的物质的量为0.1L×0.3mol/L=0.03moL,
50mL 0.2mol/L Al2(SO4)3溶液中SO42﹣的物质的量为0.05L×0.2moL/L×3=0.03mol,
混合后的总SO42﹣的物质的量为0.03moL+0.03moL=0.06mol,
溶液混合后,溶液中SO42﹣的物质的量浓度为: =0.4mol/L,
=0.4mol/L,
故选C.
点评: 本题考查物质的量浓度的计算,题目难度不大,本题注意溶液混合后总物质的量除以溶液的总体积即得溶液中SO42﹣的物质的量浓度.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6gH2O,下列说法正确的是()
A. 混合气体中一定有甲烷 B. 混合气体一定是甲烷和乙烯
C. 混合气体中一定没有乙炔 D. 混合气体中一定有丙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是()
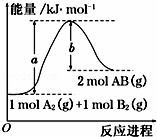
A. 该反应热△H=+(a﹣b) kJ•mol﹣1
B. 每生成2mol AB(g)吸收b kJ
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1mol A﹣A和1mol B﹣B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验事故的处理方法正确的是()
A. 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭
B. 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦
C. 皮肤上溅有较多的浓硫酸,赶紧用水冲洗
D. 衣服沾上大量的浓氢氧化钠溶液,需将此衣服浸泡在盛水的盆中
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室里需用480mL 0.1mol•L﹣1的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是()
A. 称取7.68g硫酸铜,加入500mL水
B. 称取12.0g胆矾配成500mL溶液
C. 称取8.0g硫酸铜,加入500mL水
D. 称取12.5g胆矾配成500mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
用某仪器量取液体,若仰视时读数为xmL,平视时读数为ymL,俯视时读数为zmL,若x>y>z,则所使用的仪器可能是()
A. 滴定管 B. 烧杯 C. 量筒 D. 容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2mol•L﹣1和1.5mol•L﹣1,现向该溶液中加入39.2g铁粉使其充分反应.下列有关说法正确的是()
A. 反应后溶液中Fe3+物质的量为0.8mol
B. 反应后产生13.44L H2(标准状况)
C. 反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol
D. 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物A(C4 H6O5),广泛存在于许多水果中,是一种常用的食品添加剂.该化合物具有如下性质:
i.25℃时,电离常数K1=3.99×10﹣4,K2=5.5×10﹣6
ii.Imol A与足量钠产生1.5mol H2;
ii.分子中核磁共振氢谱显示有5种不同化学环境的氢原子.与A相关的反应流程如下:
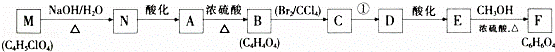
回答下列问题:
(1)A中官能团的名称为 ;B的结构简式为 ,C的系统命名为 _.
(2)A﹣﹣B的反应类型为消去反应;反应①所需的反应条件为 .
(3)写出下列反应的化学方程式:
①M﹣N. ;
②E﹣F. ,
(4)A有多种同分异构体,写出符合下列条件的同分异构体结构简式: .
①能发生水解,生成两种有机物;②水解后产物之间能发生缩聚反应.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com