
| A. | 滤液中一定含有Al3+、Ag+ | B. | 滤液中一定含有Fe2+、Ag+ | ||
| C. | 滤渣中一定含有Fe | D. | 滤渣中一定含有Ag |
分析 在金属活动性顺序中只要排在前面的金属就能把排在后面的金属从其盐溶液中置换出来,由于金属的活动性Al>Fe>Ag;用不同的金属置换同种盐溶液,盐中金属先被排在金属活动性顺序中较前的金属置换出来,另外,若有一种金属和多种混合盐溶液反应,最先反应的是最不活泼的那个金属的盐溶液,可以据此分析该题.
解答 解:由金属活动性顺序表可知,金属的活动性Al>Fe>Ag,向AgNO3溶液中加入一定质量的Fe和Al的混合粉末,铝首先与硝酸银溶液反应,铝反应完成时,铁与硝酸银反应.由于溶液显浅绿色,说明了铝全部反应,铁也参加了反应.由此可知:由上述分析可知,滤液中一定含有Fe(NO3)2、Al(NO3)3,可能含有AgNO3,故A、B错误,滤渣中一定含有Ag可能含有Fe,故C错误,D正确;
故选D.
点评 本题考查了对金属的活动性顺序的应用和金属与盐反应时应该注意的事项,培养学生分析问题、解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的核外电子数相同,是同一种核素 | |
| B. | 于${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的中子数相同,互称为同位素 | |
| C. | 于${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的质子数相同,互称为同位素 | |
| D. | 于${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的质量数相同,不能互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:| 溶质的物质的量浓度/mol•L-1 | 溶液的密度/g•cm-3 | |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热的化学反应都是吸热反应 | |
| B. | 陶瓷、玻璃和水泥都是无机非金属材料 | |
| C. | 醋酸、蔗糖均属于电解质 | |
| D. | 糖类、油脂和蛋白质都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(如图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(如图2),若原料完全反应生成三氯异氰尿酸.则氰尿酸和次氯酸的物质的量之比应为( )
三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(如图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(如图2),若原料完全反应生成三氯异氰尿酸.则氰尿酸和次氯酸的物质的量之比应为( )| A. | 1:1 | B. | 2:3 | C. | 1:2 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题



 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在乳酸菌作用下迅速分解为无毒物质.下列有关降解塑料叙述错误的是( )
在乳酸菌作用下迅速分解为无毒物质.下列有关降解塑料叙述错误的是( )| A. | 降解塑料是一种高分子化合物 | B. | 其分子量为72n | ||
| C. | 经加聚反应生成 | D. | 其单体是CH3CH(OH)COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 图中的“金属”为Na,“非金属”为S.仔细阅读两种元素在图示中经历的反应变化,回答下列问题.
图中的“金属”为Na,“非金属”为S.仔细阅读两种元素在图示中经历的反应变化,回答下列问题. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
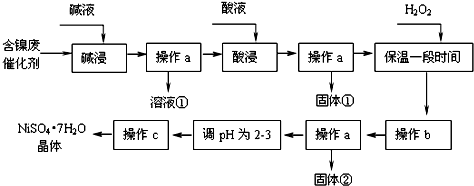
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀pH | 3.4 | 1.8 | 7.5 | 7.2 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com