
【题目】氧化锌、硫化锌都是重要的基础化工原料。
(1)ZnO是两性氧化物,ZnO在NaOH溶液中转化成[Zn(OH)4]2-的离子方程式为_____________________________________________________。
(2)火法炼锌得到的氧化锌中含有铅、铜等杂质,提纯步骤如下:
![]()
反应Ⅰ ZnO(s)+CO(g) ![]() Zn(g)+CO2(g) △H1
Zn(g)+CO2(g) △H1
反应Ⅱ 2 Zn(g)+ O2(g)=2 ZnO(s) △H2
①上图中的“冷凝物”为________(填化学式)。
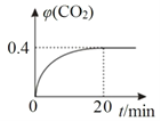
②某温度时,在反应Ⅰ的反应炉中,起始时c(CO)为0.3 molL-1,反应过程中CO2的体积分数φ(CO2)如图所示,则反应Ⅰ的平衡常数K=_______________。
③下列措施有利于提高反应Ⅰ中 ZnO 转化率的是________。
a.增大ZnO的投料量 b.适当加压 c.将锌蒸气及时分离
④反应Ⅱ中,每转移 1 mol 电子,反应放热 174 kJ,则△H2=_____________。
(3)测定氧化锌样品纯度:称取0.5000 g样品,酸溶后定容于250 mL容量瓶中,摇匀。量取25.00 mL 该溶液,用0.04000 molL-1的EDTA(Na2H2Y)标准溶液滴定其中的Zn2+(反应方程式为Zn2++H2Y2-=ZnY2-+2H+,杂质不反应),平行滴定三次,平均消耗EDTA标准溶液15.12 mL。
①若滴定管未用 EDTA 标准液润洗,测定结果将__________(填“偏高”、“偏低”或“不变”)。
②样品纯度为___________(保留四位有效数字)。
【答案】ZnO+2OH-+H2O=[Zn(OH)4]2- Zn 0.4 c -696 kJ/mol 偏高 97.98%
【解析】
(1)ZnO和Al2O3的化学性质相似,氧化铝与氢氧化钠反应生成偏铝酸钠,据此模仿写出氧化锌与氢氧化钠的反应;
(2)①反应Ⅰ:ZnO(s)+CO(g)Zn(g)+CO2(g),锌蒸气冷凝为冷凝物;
②结合平衡三行计算列式计算平衡浓度,利用平衡常数K的定义分析计算;
③有利于提高反应Ⅰ中ZnO转化率,平衡正向进行;
④反应Ⅱ中,每转移1mol电子,反应放热174kJ,结合反应定量关系和电子转移总数计算,转移4mol电子放热696kJ;
(3)①滴定管未用EDTA标准液润洗,内层水膜会稀释标准溶液,消耗标准溶液体积会增大;
②称取0.5000g样品,酸溶后定容于250mL容量瓶中,摇匀.量取25.00mL该溶液,用0.04000molL-1的EDTA(Na2H2Y)标准液滴定其中的Zn2+(反应方程式为Zn2++H2Y2-═ZnY2-+2H+,杂质不反应),平行滴定三次,平均消耗EDTA标准液15.12mL.
Zn2++H2Y2-═ZnY2-+2H+,
1 1
n 15.12×10-3L×0.04000mol/L
n(ZnO)=n(Zn2+)=15.12×10-3L×0.04000mol/L,
250mL溶液中n(ZnO)=15.12×10-3L×0.04000mol/L×![]() ,据此计算质量分数;
,据此计算质量分数;
(1)![]() 是两性氧化物,和
是两性氧化物,和![]() 的化学性质相似,氧化铝与氢氧化钠反应生成四羟基合铝酸钠,所以氧化锌与氢氧化钠的反应的方程式为:
的化学性质相似,氧化铝与氢氧化钠反应生成四羟基合铝酸钠,所以氧化锌与氢氧化钠的反应的方程式为:![]() ;
;
故答案为:![]() ;
;
(2)①反应Ⅰ:![]() ,锌蒸气冷凝,冷凝物为金属锌,故答案为:Zn;
,锌蒸气冷凝,冷凝物为金属锌,故答案为:Zn;
②某温度时,在反应Ⅰ的反应炉中,起始时c(![]() )为0.3molL1,反应过程中达到平衡
)为0.3molL1,反应过程中达到平衡![]() 的体积分数φ(
的体积分数φ(![]() )如图所示为0.4,列三段式(单位是molL1):
)如图所示为0.4,列三段式(单位是molL1): 
![]() ,解得
,解得![]() ,则平衡常数
,则平衡常数![]() ;
;
故答案为:0.4;
③a.增大![]() 的投料量,氧化锌为固体不影响平衡,氧化锌转化率不变,故a/span>错误;
的投料量,氧化锌为固体不影响平衡,氧化锌转化率不变,故a/span>错误;
b.反应前后气体体积不变,适当加压,不影响平衡移动,故b错误;
c.将锌蒸气及时分离,平衡正向进行氧化锌转化率增大,故c正确;
故答案为:c;
④反应Ⅱ中![]() ,反应中2mol
,反应中2mol![]() 完全反应电子转移4mol,反应每转移1mol 电子,反应放热174kJ,转移4mol电子反应放热696KJ,反应焓变
完全反应电子转移4mol,反应每转移1mol 电子,反应放热174kJ,转移4mol电子反应放热696KJ,反应焓变![]() ;
;
故答案为:696 kJ/mol;
(3)①滴定管未用 EDTA 标准液润洗,内层水膜会稀释标准溶液,消耗标准溶液体积会增大,测定结果偏高,
故答案为:偏高;
②称取0.5000g样品,酸溶后定容于250mL容量瓶中,摇匀;量取25.00mL该溶液,用0.04000molL1的EDTA(![]() )标准液滴定其中的
)标准液滴定其中的![]() (反应方程式为
(反应方程式为![]() ,杂质不反应),平行滴定三次,平均消耗EDTA标准液15.12mL;样品纯度=
,杂质不反应),平行滴定三次,平均消耗EDTA标准液15.12mL;样品纯度=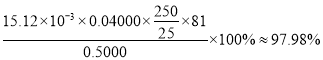 ;
;
故答案为97.98%。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】市场销售的某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量 | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式![]() 将化学计量数填于空白处
将化学计量数填于空白处![]()
______ ![]() ______
______ ![]() ______
______ ![]() ______
______ ![]() ______
______ ![]() ______
______ ![]()
(2)已知:![]() 某学生测定食用精制盐的碘含量,其步骤为:
某学生测定食用精制盐的碘含量,其步骤为:
![]() 准确称取12.7g食盐,加适量蒸馏水使其完全溶解;
准确称取12.7g食盐,加适量蒸馏水使其完全溶解;
![]() 用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
![]() 以淀粉为指示剂,逐滴加入物质的量浓度为6.0×10-4molL-1的Na2S2O2溶液20.0mL,恰好反应完全.
以淀粉为指示剂,逐滴加入物质的量浓度为6.0×10-4molL-1的Na2S2O2溶液20.0mL,恰好反应完全.
![]() 判断c中反应恰好完全依据的现象是 ______ .
判断c中反应恰好完全依据的现象是 ______ .
![]() 根据以上实验和包装袋说明,所测精制盐的碘含量是 ______mg/kg.
根据以上实验和包装袋说明,所测精制盐的碘含量是 ______mg/kg.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如下图所示
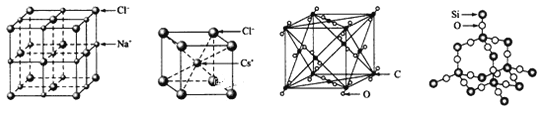
(1) 在NaCl的晶胞中,与Na+最近且等距的Na+有_____个,在NaCl的晶胞中有Na+_____个,Cl-____个
(2)在CsCl的晶胞中,Cs+与Cl-通过_________结合在一起。
(3) 1mol二氧化硅中有______mol硅氧键。
(4)设二氧化碳的晶胞密度为a g/cm3,写出二氧化碳的晶胞参数的表达式为____n m (用含NA的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制溴苯可用如图装置。回答下列问题:
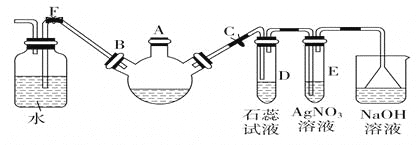
(1)关闭F夹,打开C夹,向装有少量苯的三口烧瓶的A口加少量溴,再加少量铁屑,塞住A口,则三口烧瓶中发生的有机化学反应方程式为_______________________。
(2)D试管内出现的现象为________________;E试管内出现的现象为________________。
(3)待三口烧瓶中仍有气泡冒出时打开F夹,关闭C夹,可看到的现象是_____________________。
(4)从溴苯中除去溴,用NaOH溶液处理后再洗涤,反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置图 |
|
|
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | Ksp:AgCl>AgBr>AgI | 非金属性:C>Si |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验方案能达到实验目的的是
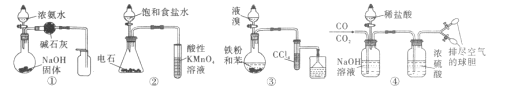
A.用图①的装置制取并收集干燥的NH3B.用图②的装置验证乙炔的还原性
C.用图③的装置制取溴苯D.用图④的装置分离CO和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用电子式表示H2O和MgBr2的形成过程:
H2O_________
MgBr2__________
(2)写出CO2、Na2O2、H2O2的电子式:
CO2___________Na2O2________ H2O2________
(3)A+、B+、C-、D、E 5种离子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:
A.A++ C- → D + E b.B++ C- → 2D 。据此回答下列问题:
①写出A反应的离子方程式________;
②写出A+、C-离子的电子式:A+________ C-__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的短周期主族元素,R为过渡元素。Y的最高价氧化物的水化物是强酸,Z元素的基态原子中有2个未成对电子,基态W原子的价电子排布式为nsn-1npn-1,X与W为同主族元素。基态R原子的M能层全充满,核外有且仅有1个未成对电子。请回答下列问题:
(1)基态R原子核外价电子排布式为___。
(2)X、Y、Z三种元素的第一电离能由大到小的顺序为___(填元素符号)。
(3)元素Y的简单气态氢化物的沸点___(填“高于”或“低于”)元素X的简单气态氢化物的沸点,其主要原因是___;元素Y的简单气态氢化物中Y原子的杂化类型为___,元素X的简单气态氢化物分子的空间构型为___。
(4)Y的气态氢化物在水中可形成氢键,其氢键最可能的形式为___(填序号)。
A.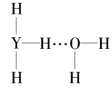 B.
B. 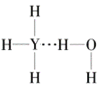 C.
C.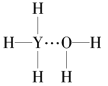 D.
D.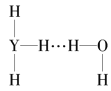
(5)R元素与Y元素形成的某种化合物的晶胞结构如图所示(黑球代表R原子),若该晶胞的边长是acm,则该晶体的密度为___g·cm-3(用NA表示阿伏加德罗常数的值)。
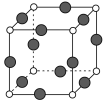
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.向沸水中滴加![]() 溶液制备
溶液制备![]() 胶体:
胶体:![]()
B.用![]() 溶液腐蚀印刷铜电路板:
溶液腐蚀印刷铜电路板:![]()
C.用小苏打治疗胃酸过多:![]()
D.实验室用浓盐酸与![]() 反应制
反应制![]() :
:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com