
分析 (1)由于实验室无220mL容量瓶,故应选用250mL容量瓶,而配置出250mL溶液,根据所需的质量m=CVM来计算;根据配制一定物质的量浓度的溶液的步骤是称量、溶解、冷却、移液、洗涤、定容、摇匀和装瓶来分析所需的仪器;
(2)容量瓶上标有唯一一条刻度线、温度和容积;
(3)根据配制一定物质的量浓度的溶液的步骤是称量、溶解、冷却、移液、洗涤、定容、摇匀和装瓶来对操作步骤来排序;
(4)A、使用容量瓶前要检查它是否漏水,防止在配制溶液过程中漏液;
B、容量瓶用蒸馏水洗净后,再用待配液润洗,会导致所配溶液浓度偏大;
C、很多固体在溶解过程中会放热,要等冷却至室温再转移进容量瓶;
D、配制溶液时,要先溶解稀释,冷却至室温以后,再转移至容量瓶;
E、摇匀时食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转反复上下摇匀.
(5)分析具体操作对n、V的影响,根据c=$\frac{n}{V}$分析不当操作对溶液浓度的影响;
(6)与等质量的水混合时,溶液质量加倍,则质量分数减半;氢氧化钠溶液的密度大于水的密度,等体积混合后所得溶液的质量小于原来的2倍,而氢氧化钠的质量不变,结合质量分数公式判断.
解答 解:(1)由于实验室无220mL容量瓶,故应选用250mL容量瓶,而配置出250mL溶液,故所需的质量m=CVM=1.25mol/L×0.25L×40g/mol=12.5g;
根据配制一定物质的量浓度的溶液的步骤是称量、溶解、冷却、移液、洗涤、定容、摇匀和装瓶可知所需的仪器有托盘天平、烧杯、玻璃棒、250mL容量瓶和胶头滴管,故还需要250mL容量瓶和玻璃棒,故答案为:12.5g,250mL容量瓶和玻璃棒;
(2)容量瓶上标有唯一一条刻度线、温度和容积,故答案为:①③⑤;
(3)根据配制一定物质的量浓度的溶液的步骤是称量、溶解、冷却、移液、洗涤、定容、摇匀和装瓶可知正确的操作顺序是B、C、A、F、E、D,故答案为:B、C、A、F、E、D;
(4)A、使用容量瓶前要检查它是否漏水,防止在配制溶液过程中漏液,故A正确;
B、容量瓶用蒸馏水洗净后,再用待配液润洗,会导致所配溶液浓度偏大,故B错误;
C、很多固体在溶解过程中会放热,要等冷却至室温再转移进容量瓶,故C错误;
D、配制溶液时,要先溶解稀释,冷却至室温以后,再转移至容量瓶,故D错误;
E、摇匀时食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转反复上下摇匀,故E正确.
故选:AE;
(5)A.称量NaOH时,砝码错放在左盘,会导致溶质的质量偏小,则浓度偏低,故A正确;
B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面,会导致溶质的损失,则浓度偏低,故B正确;
C.加蒸馏水时不慎超过了刻度线,则溶液体积偏大,浓度偏低,故C正确;
D.定容时俯视刻度线,则溶液体积偏小,浓度偏高,故D错误;
E.配制前,容量瓶中有少量蒸馏水对浓度无影响,故E错误.
故选ABC.
(6)与等质量的水混合时,溶液质量加倍,故质量分数减半,即b=$\frac{a}{2}$;氢氧化钠溶液的密度大于水的密度,故与等体积的水混合后所得溶液的质量小于原来的2倍,而氢氧化钠的质量不变,由质量分数=$\frac{{m}_{溶质}}{{m}_{溶液}}$可知,所得溶液中溶质的质量分数大于c>$\frac{a}{2}$,故答案为:a>c>b=$\frac{a}{2}$;
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,难度不大,掌握公式的运用和配制原理是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | c1:c2>1:2 | |
| B. | A和B的转化率不相等 | |
| C. | 平衡时,B和C的生成速率之比1:1 | |
| D. | c2的取值范围为0<c2<0.28 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、CO32-、Cl-、NO3- | B. | MnO4-、K+、OH-、SO42- | ||
| C. | Cl-、SO42-、Cu2+、Ba2+ | D. | Mg2+、Na+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
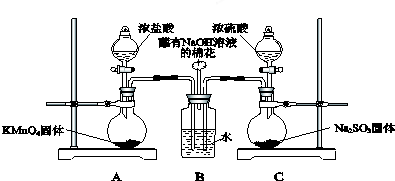
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的烷烃,含有3个甲基结构的同分异构体有2种 | |
| B. | 丙烯能发生加成反应,还能使酸性KMnO4溶液褪色 | |
| C. | 甲苯中所有原子都处于同一平面 | |
| D. | 相同质量的甲烷和乙烷完全燃烧,乙烷耗氧量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
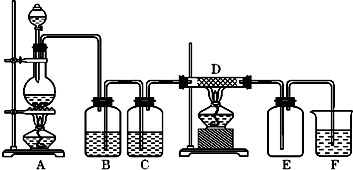
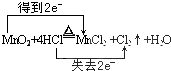 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com