
【题目】甲苯是有机化工生产的基本原料之一。利用乙醇和甲苯为原料,可按下列路线合成分子式均为C9H10O2的有机化工产品E和J。
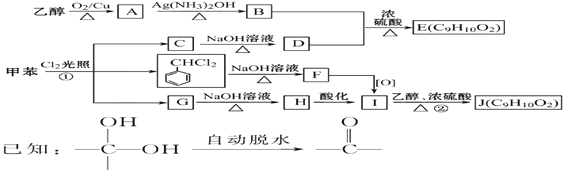
请回答:
(1)①的反应类型为_________________; J的官能团名称是_______________;
(2)D的化学名称是_________________________, F的结构简式为__________________________。
(3)写出下列反应方程式
①乙醇→A: ________________________________________________________。
② C→D:________________________________________________________。
③B+D→E: _____________________________________________________。
④G→H:________________________________________________________。
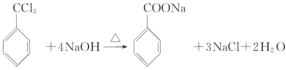
【答案】取代反应酯基苯甲醇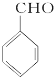 2CH3CH2OH+O2
2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O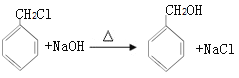
【解析】
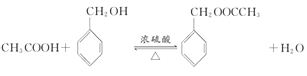
乙醇被氧气氧化生成A,A为乙醛,乙醛被氧化生成乙酸,乙酸和D反应生成E,根据乙酸和E的分子式可知,D为苯甲醇,C和氢氧化钠的水溶液发生取代反应生成苯甲醇,则C为一氯甲苯,二氯甲苯和氢氧化钠的水溶液发生取代反应生成F,结合题给信息可知,F是苯甲醛,苯甲醛被氧化生成苯甲酸,G和氢氧化钠水溶液反应生成H,H酸化生成苯甲酸,则H是苯甲酸钠,G是三氯甲苯,乙醇和苯甲酸反应生成J苯甲酸乙酯。(1) ①为甲苯和氯气在光照条件下的取代反应,J为苯计算乙酯,官能团为酯基; (2)通过以上分析可知 D为苯甲醇,F的结构简式为 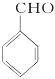 ;(3) ①乙醇氧化生成乙醛和水,方程式为:2CH3CH2OH+O2
;(3) ①乙醇氧化生成乙醛和水,方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O ;②一氯甲苯和氢氧化钠发生取代反应生成苯甲醇和氯化钠,方程式为:
2CH3CHO+2H2O ;②一氯甲苯和氢氧化钠发生取代反应生成苯甲醇和氯化钠,方程式为:  ;③B+D→E为酯化反应,方程式为:
;③B+D→E为酯化反应,方程式为: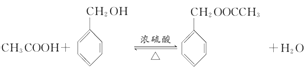 ④G→H的反应为三氯甲苯和氢氧化钠反应,方程式为:
④G→H的反应为三氯甲苯和氢氧化钠反应,方程式为: 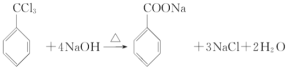 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】CH![]() 、—CH3、CH
、—CH3、CH![]() 都是重要的有机反应中间体,有关它们的说法正确的是( )
都是重要的有机反应中间体,有关它们的说法正确的是( )
A. 它们互为等电子体,碳原子均采取sp2杂化
B. CH![]() 与NH3、H3O+互为等电子体,立体构型均为正四面体形
与NH3、H3O+互为等电子体,立体构型均为正四面体形
C. CH![]() 中的碳原子采取sp2杂化,所有原子均共面
中的碳原子采取sp2杂化,所有原子均共面
D. CH![]() 与OH-形成的化合物中含有离子键
与OH-形成的化合物中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代有“女蜗补天”的传说,今天人类也面临“补天”的问题,下列采取的措施与今天所说的“补天”无关的是
A. 禁止使用含氟电冰箱
B. 倡导使用无磷洗衣粉
C. 硝酸厂的尾气按相关规定处理
D. 研究新型催化剂,消除汽车尾气的污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物。请回答下列问题:
(1)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Mn属于________区。某一次性电池负极材料是Zn,正极材料是Mn的一种常见氧化物,放电后生成MnOOH,电解质是KOH。该电池的正极反应式为__________________________。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti2+中电子占据的最高能层符号为________,该能层具有的原子轨道数为________。BH4-的立体构型是________。
(3)单质Cu的晶体类型为______,晶体中组成微粒通过________作用形成面心立方密堆积,其中Cu原子的配位数为______。在Cu的催化作用下,乙醇可被空气中氧气氧化为乙醛,乙醛分子中碳原子的杂化方式是________,乙醛分子中∠HCO的键角________乙醇分子中∠HCO的键角(填“大于”、“等于”或“小于”)。
(4)单质铁有δ、γ、α三种同素异形体,三种晶胞中Fe原子的配位数之比为________,δ、γ、α三种晶胞的边长之比为________。
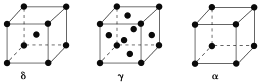
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为元素周期表中前四周期元素,原子序数依次增大,A元素原子核外有3个未成对电子,B元素原子核外电子占用3个能级,其中最高能级上的电子数是其所在能层数的2倍,D元素与B元素同族,C元素与A元素同族,E元素的负一价离子的最外层电子数与次外层的相同。F元素原子的价电子数比其余电子数少8。
(1)A、C、D的第一电离能由大到小的顺序为_____________(用元素符号表示),F在元素周期表中的位置__________。
(2)B、D形成的化合物中属于非极性分子的是_______(填化学式)。
(3)B、C形成的某种化合物结构如图所示,该结构中C-B键的键长有两类,键长较短的键为_______________(填图中字母a或b),1mol该分子中含有的σ键数目为________。C、E形成某化合物,其分子中所有原子的最外层均为8电子稳定结构,该化合物的电子式为________。
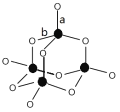
(4)元素E的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。
(5)F可与CO形成羰基配合物F2(CO)8,橘红色固体,是有机合成的重要催化剂,可用作汽油抗震剂等,不溶于水,溶于乙醇、乙醚、苯,熔点50~51℃,45℃(1.33kPa)时升华。
①F2(CO)8为_________晶体(填晶体类型)。
②F2(CO)8晶体中存在的作用力有_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸)。
(1)实验室可用硫化亚铁固体与稀硫酸反应来制备H2S气体。
①该反应的化学方程式为____________________________。
②多余的H2S气体可用_____________溶液来吸收,不能用燃烧的方法处理H2S气体的理由是___________。
(2)用30% FeCl3溶液作吸收液也能吸收H2S气体,反应方程式为:2FeCl3+H2S = S↓+2FeCl2+2HCl,废吸收液经电解可循环使用。
①该反应中H2S显__________(填字母)。
a、不稳定性 b、弱酸性 c、氧化性 d、还原性
②检验废吸收液中是否含有Fe3+的适宜试剂是___________。
③强酸性的废吸收液电解可生成FeCl3和一种分子量最小的气体,则化学方程式为____________。
(3)已知:H2S在高温下分解生成硫蒸气和H2。现测得某温度下,H2S分解过程中各物质的物质的量随时间变化关系如图所示。
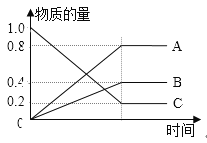
①表示H2的曲线是__________(填“A”、“B”或“C”)。
②生成硫蒸气的分子式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中不正确的是 ( )
A. 沉淀中氢氧根的质量为(n-m)克
B. 恰好溶解后溶液中的NO3-离子的物质的量为![]() mol
mol
C. 生成标准状况下NO气体的体积为![]() L
L
D. 与合金反应反应的硝酸的物质的量为(![]() +
+![]() )mol
)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙二醇(PEG) 是一种用途广泛的聚合物,1,2-乙二醇碳酸酯(又称为碳酸亚乙酯) 是一种医药中间体。某小组以烃A 为原料合成PEG和碳酸亚乙酯的路线设计如下: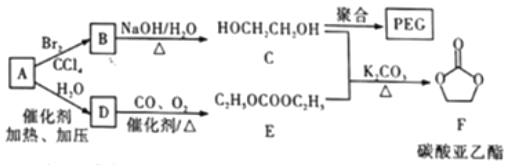
已知: 2C2H5OH+CO+1/2O2 ![]() C2H5OCOOC2H5+H2O
C2H5OCOOC2H5+H2O
回答下列问题:
(1)A→B的反应类型为__________。
(2)B→C的化学方程式为______。
(3)C在一定条件下发生聚合反应生成PEG,若某种PEG的平均相对分子质量为2000, 则其平均聚合度为____________________。
(4)E的同分异构体中,含有—OCOO—基团的共有______ 种(不包含E和立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运载火箭常用偏二甲肼(C2H8N2)(其中N的化合价为-3)作燃料和四氧化二氮(N2O4)反应。在火箭升空过程中,燃料发生反应:C2H8N2+2N2O4![]() 2CO2+3N2+4H2O提供能量。下列有关叙述正确的是
2CO2+3N2+4H2O提供能量。下列有关叙述正确的是
A. 该燃料绿色环保,在燃烧过程中不会造成任何环境污染
B. 该反应中N2O4是氧化剂,偏二甲肼是还原剂
C. N2既是氧化产物又是还原产物,CO2既不是氧化产物也不是还原产物
D. 每有0.6 mol N2生成,转移电子数目为2.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com