
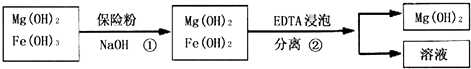
| 1 |
| 2 |
| 1 |
| 2 |
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
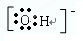 ;
;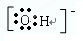 ;
;| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、用白醋清洗热水瓶中的水垢 |
| B、用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物 |
| C、用铝锅长时间存放剩菜 |
| D、利用激光笔区别鸡蛋白溶液和浓盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、该氖原子的相对原子质量可以表示为
| ||
| B、该氖原子的相对原子质量可以表示为aNA | ||
C、W g该氖原子的物质的量一定是
| ||
| D、12b=NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧原子发生SP杂化 |
| B、该分子为V型分子 |
| C、氧原子与H、Cl都形成π键 |
| D、该原子的电子式为H:O:Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
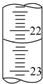 实验室中有一未知浓度的稀盐酸,某学生用0.10mol?L-1 NaOH标准溶液进行测定盐酸的浓度的实验.取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生用0.10mol?L-1 NaOH标准溶液进行测定盐酸的浓度的实验.取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.请完成下列填空:| 实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol?L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
| 1 | 20.00 | 0.10 | 24.18 |
| 2 | 20.00 | 0.10 | 23.06 |
| 3 | 20.00 | 0.10 | 22.96 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
试验编号 | T/K | V水/ml | V(Na2S2O3)/ml | V(H2SO4)/ml | 实验目的 |
| ① | 298 | 10 | 5 | 5 | 实验①和②探究温度对该反应速率的影响. 实验①和③探究 对化学反应速率的影响. 实验①和④探究 对化学反应速率的影响. |
| ② | 308 | 10 | 5 | 5 | |
③ | 298 | Vx | 10 | 5 | |
| ④ | 298 | 10 | 5 | 5 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体于试管中,加适量蒸馏水溶解 | |
| 步骤2:向试管中加入 | |
| 步骤3:取 | 若有白色沉淀生成,证明固体中混有Na2SO4;若无白色沉淀生成,证明固体中无Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
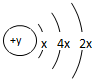 ,D在同周期元素中原子半径最小,据此填空:
,D在同周期元素中原子半径最小,据此填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com