
| A.通过浓硫酸除去HCl中的H2O | B.通过灼热的CuO除去H2中的CO |
| C.通过灼热的镁粉除去N2中的O2 | D.通过水除去CO中的CO2 |
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源:不详 题型:单选题
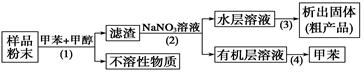
| A.步骤(1)需要过滤装置 |
| B.步骤(2)需要用到分液漏斗 |
| C.步骤(3)需要用到坩埚 |
| D.步骤(4)需要蒸馏装置 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
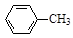 + 2KMnO4
+ 2KMnO4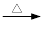
 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O + HCl
+ HCl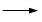
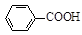 +KCl
+KCl
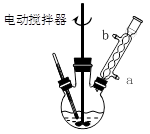
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 Na2S2O3(aq)
Na2S2O3(aq)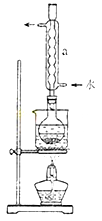
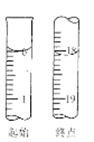
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.澄清石灰水,浓H2SO4 | B.酸性KMnO4,浓H2SO4 |
| C.溴水,浓H2SO4 | D.浓H2SO4,溴水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
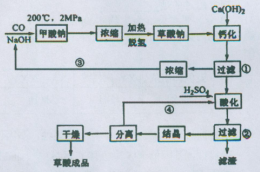
查看答案和解析>>
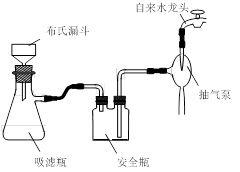
科目:高中化学 来源:不详 题型:实验题
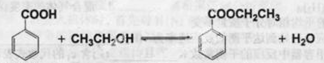
| 名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g·cm-3) |
| 苯甲酸* | 122 | 无色片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
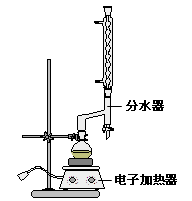
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
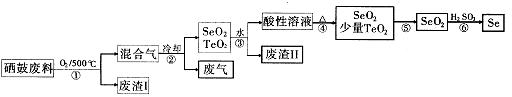
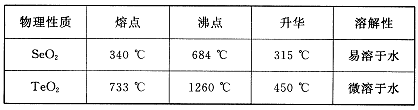
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com