
| A. | 苯中加入溴水后溴水层颜色变浅,这是由于发生了取代反应 | |
| B. | 乙烯和苯分子中所有原子在同一平面上 | |
| C. | 一氯丙烷(C3H7Cl)的同分异构体共有3种 | |
| D. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA |
分析 A.苯和溴水发生萃取;
B.苯和乙烯分子都是平面机构,所以苯乙烯分子中所有原子可能共平面;
C.根据等效氢来判断同分异构体;
D.标准状况下,CHCl3为液态.
解答 解:A.苯中加入溴水后溴水层颜色变浅,发生萃取而非取代,故A错误;
B.苯分子和乙烯分子都是平面结构,两分子中所有原子共平面,所以苯乙烯分子中所有原子可以在同一个平面上,故B正确;
C.丙烷(C3H8)中有2种氢原子,所以一氯丙烷(C3H7Cl)的同分异构体共有2种,故C错误;
D.标准状况下,CHCl3为液态,无法计算2.24LCHCl3含有的分子数,故D错误;
故选B.
点评 本题考查了有机物的结构与性质,题目难度不大,注意掌握常见有机物的结构及具有的化学性质,明确常见有机物分子空间构型.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
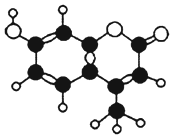 可调谐激光器所用的某种染料由C、H、O三种元素组成,分子球棍模型如图所示,下列关于该染料的叙述正确的是( )
可调谐激光器所用的某种染料由C、H、O三种元素组成,分子球棍模型如图所示,下列关于该染料的叙述正确的是( )| A. | ①③⑤ | B. | ③④⑤ | C. | ③④⑤⑥ | D. | ②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2都能与水反应生成相应的酸 | |
| B. | 硅可以用做半导体材料,SiO2可用于制光导纤维 | |
| C. | 氢氧化钠溶液保存在磨口玻璃塞的试剂瓶中 | |
| D. | 玻璃是人类最早使用的硅酸盐材料,玻璃加热熔化时有固定的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | XZ线上任意点均呈中性,pH=7 | |
| B. | 两条曲线间任意点均有c(H+)•c(OH-)=Kw | |
| C. | M区域内任意点均有c(H+)<c(OH-) | |
| D. | 图中T1<T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| B. | 海水淡化的方法有蒸馏法、离子交换法和电渗析法等 | |
| C. | 用乙醚从黄花蒿中提取青蒿素利用了萃取原理 | |
| D. | 水泥厂常用高压电除去工厂烟尘,利用了胶体的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
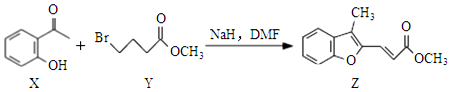
| A. | 物质X的分子中存在2种含氧官能团 | |
| B. | 物质Y可以发生水解和消去反应 | |
| C. | 1molZ最多可与2molBr2发生加成反应 | |
| D. | 等物质的量的X、Y分别与NaOH溶液反应,最多消耗的NaOH的物质的量之比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com