
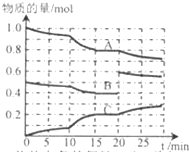
 �ں㶨�¶�t�棬2L�����ܱ������з�����ӦaA��g��+bB��g��?cC��g����������A��B��C���ʵ����仯��ͼ��ʾ���ش��������⣺
�ں㶨�¶�t�棬2L�����ܱ������з�����ӦaA��g��+bB��g��?cC��g����������A��B��C���ʵ����仯��ͼ��ʾ���ش��������⣺���� ��1����ͼ���֪��15min�ﵽƽ�⣬��Ӧ��A���ʵ����仯0.2mol��B�仯���ʵ���0.1mol��C�仯���ʵ���0.2mol����ѧ����ʽ�ļ�����֮�ȵ���A��B��C������Ӧ�����ʵ���֮�ȣ����ƽ��״̬�����ʵ�ƽ��Ũ�ȼ��㷴Ӧ��ƽ�ⳣ����
��2����ͼ�жϣ���Ӧ������20minʱB����ͻȻ����A�����ʵ�����С��C���ʵ����������ݻ�ѧƽ��Ӱ�����ط�����ƽ��������У�A��ת��������
��3��10min��15min�����߱仯����AB���ʵ�����С��C�����ʵ�������Ӧ�����������ﵽ��ͬ��ƽ��״̬��˵�����ܵ�ԭ���Ǵ��������ã�
��� �⣺��1������ͼ������жϣ�15min�ﵽƽ�⣬��Ӧ��A���ʵ����仯0.2mol��B�仯���ʵ���0.1mol��C�仯���ʵ���0.2mol����ѧ����ʽ�ļ�����֮�ȵ���ABC������Ӧ�����ʵ���֮�ȣ�a��b��c=0.2��0.1��0.2=2��1��2��
ƽ��״̬��A��B��C��Ũ��Ϊ��c��A��=$\frac{0.8mol}{2L}$=0.4mol/L��c��B��=$\frac{0.4mol}{2L}$=0.2mol/L��c��C��=$\frac{0.2mol}{2L}$=0.1mol/L���÷�Ӧ��ƽ�ⳣ��Ϊ��K=$\frac{{c}^{2}��C��}{{c}^{2}��A��•c��B��}$=$\frac{0��{1}^{2}}{0��{4}^{2}0.2}$=0.31��
�ʴ�Ϊ��2��1��2��0.31��
��2����Ӧ���е�20 minʱ��B�����ʵ���ͻȻ����A��C�����ʵ���˲ʱ���䣬������������B����������B������ƽ�������ƶ�������������B�����ʵ��������´ﵽƽ��ʱB���������������
�ʴ�Ϊ��������B�����ʵ������ң�����
��3��10min��15min�����߱仯����AB���ʵ�����С��C�����ʵ�������Ӧ�����������ﵽ��ͬ��ƽ��״̬��˵���ı�� �����Ǽ����˴������ı䷴Ӧ���ʲ��ı仯ѧƽ�⣬
�ʴ�Ϊ��ʹ���˴�����
���� ���⿼���˻�ѧƽ��ļ��㣬��Ŀ�Ѷ��еȣ���ȷͼ�����߱仯�ĺ���Ϊ���ؼ���ע�����ջ�ѧƽ�⼰��Ӱ�죬����������ѧ���Ļ�ѧ����������


 �Űٷֿ�ʱ����ϵ�д�
�Űٷֿ�ʱ����ϵ�д� ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���еĻ�ѧ��Ӧ | B�� | ���淴Ӧ | ||
| C�� | ������ԭ��Ӧ | D�� | ��������֮��ķ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �����ռ��ڹ�ũҵ������ҵ��ˮ�����о��й㷺��;���ش��������⣺
�����ռ��ڹ�ũҵ������ҵ��ˮ�����о��й㷺��;���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��һ�������£���������������������·�Ӧ��2SO2��g��+O2 ��g��?2SO3��g�� ����H��0��
��һ�������£���������������������·�Ӧ��2SO2��g��+O2 ��g��?2SO3��g�� ����H��0���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 2009��10��15���»��籨����ȫ��ũ��Ӧ���ڡ���ɫ��̬•�������•��̼����•ѭ����չ�������������£�������õط�չ���й���ɫ��ׯ�������롰��̫���ʵ�̼ũׯ�����裮�ɼ�����̼ѭ�����Ѿ������˹�������ӣ��Իش��������⣺
2009��10��15���»��籨����ȫ��ũ��Ӧ���ڡ���ɫ��̬•�������•��̼����•ѭ����չ�������������£�������õط�չ���й���ɫ��ׯ�������롰��̫���ʵ�̼ũׯ�����裮�ɼ�����̼ѭ�����Ѿ������˹�������ӣ��Իش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ba��OH��2��Һ����μ���NH4HSO4��Һ���պó�����ȫ��Ba2++2OH-+H++SO42-+NH4+=BaSO4��+NH3•H2O+H2O | |
| B�� | ���Ƶ�ˮ�⣺S2-+2H2O?H2S+2OH- | |
| C�� | ��Fe��NO3��3��Һ�м��������HI��Һ��Fe3++3NO3-+10I-+12H+=5I2+Fe2++3NO��+6H2O | |
| D�� | NaHCO3��Һ�еμ���������ʯ��ˮ��2HCO3-+Ca2++2OH-=CaCO3��+2H2O+CO32- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com