
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热725.8KJ;
(2)①C(s)+O2(g)═CO2(g);△H=-393.5kJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol依据盖斯定律,①-②计算.
解答 解:(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热为22.68kJ×32=725.8KJ,所以甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ•mol-1;
(2)①C(s)+O2(g)═CO2(g);△H=-393.5kJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol依据盖斯定律,①-②得可得:C燃烧生成CO的热化学方程式为:C(s)+$\frac{1}{2}$O2(g)=CO (g)△H=-110.5kJ/mol,
故答案为:C(s)+$\frac{1}{2}$O2(g)=CO (g)△H=-110.5kJ/mol.
点评 本题考查了有关反应热的计算、热化学方程式的书写,题目难度中等,注意掌握盖斯定律的含义,能够利用盖斯定律书写目标热化学方程式,明确反应热的计算方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
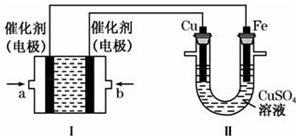
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
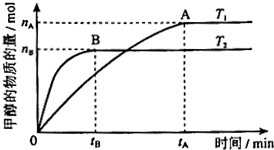 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
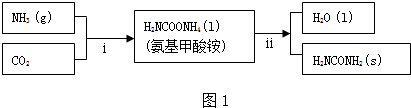

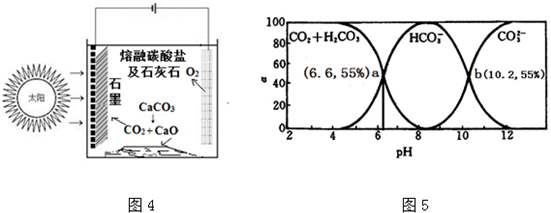
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0×10-6mol/L | B. | 3.2×10-6mol/L | C. | 2.0×10-9mol/L | D. | 3.2×10-9mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在限量范围内使用不会对人体造成危害 | |
| B. | 只有不法商贩才使用食品添加剂 | |
| C. | 不使用食品添加剂的纯天然食品最安全 | |
| D. | 食品添加剂就是为食品好卖出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com