
| A. | C5H12 | B. | C4H10 | C. | C3H6 | D. | C3H8 |
科目:高中化学 来源: 题型:选择题
| A. | 常温下,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| B. | 0.5 mol苯分子中含有C=C双键数为1.5 NA | |
| C. | 1 mol甲基(-CH3)所含的电子总数为10 NA | |
| D. | 标准状况下,1L甲醇完全燃烧后生成的CO2分子数目约为$\frac{{N}_{A}}{22.4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
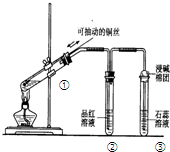
| A. | 上下移动①中铜丝可控制SO2的量 | |
| B. | ②中品红溶液不褪色 | |
| C. | ③中石蕊溶液变蓝色 | |
| D. | 为确认CuSO4生成,向①中加水,观察溶液颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 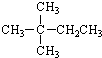 | B. | 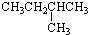 | C. | CH3CH2CH2CH2CH3 | D. | CH3CH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+) | |
| B. | Va=Vb时:c(CH3COOH)+c(H+)>c(OH-) | |
| C. | Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+) | |
| D. | Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 决定反应速率的因素是反应物的浓度 | |
| B. | 在金厲钠与足量水反应中,增加水的量能加快反应速率 | |
| C. | 在可逆反应中,反应物不可能完全转化为生成物 | |
| D. | 可逆反应达到平衡时,正、逆反应速率相等且等于零 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com