
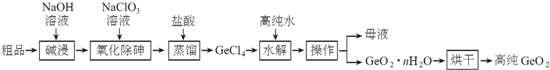
分析 二氧化锗粗品(主要含GeO2、As2O3)中加入NaOH溶液碱浸,发生的反应为GeO2+2NaOH═Na2GeO3+H2O、As2O3+2NaOH═2NaAsO2+H2O,向溶液中加入NaClO3氧化除砷,发生的反应为3NaAsO2+NaClO3+6 NaOH=3 Na3AsO4+NaCl+3H2O,向溶液中加入稀盐酸并蒸馏,“蒸馏”过程中的反应为:Na2GeO3+6HCl═2NaCl+GeCl4+3H2O,所以得到GeCl4,向GeCl4中加入高纯水,发生的水解反应为GeCl4+(n+2)H2O=GeO2•n H2O↓+4HCl,然后过滤得到母液和GeO2•n H2O,将GeO2•n H2O烘干得到高纯的GeO2,
(1)锗的原子序数为32,锗在元素周期表中的位置为第四周期IVA族;
(2)“氧化除砷”的过程是将NaAsO2氧化为Na3AsO4,同时氯酸钠被还原生成氯化钠,根据反应物和生成物书写反应方程式;
(3)传统的提纯方法是将粗品直接加入盐酸中蒸馏,馏出物中将会含有AsCl3;
(4)工业上与蒸馏操作相关的设备有蒸馏釜和冷凝塔;
(5)“水解”时生成GeO2•n H2O和HCl,温度高时GeCl4易挥发,且该反应是放热反应,升高平衡平衡逆向移动;
(6)1吨二氧化锗粗品(含杂质30%)中杂质质量=1t×30%=0.3t,纯的二氧化锗质量=1t×(1-30%)=0.7t,实际上经提纯得0.745吨的高纯二氧化锗产品,则提纯得到的二氧化锗中杂质质量=(0.745-0.7)t=0.045t,据此计算杂质去除率.
解答 解:二氧化锗粗品(主要含GeO2、As2O3)中加入NaOH溶液碱浸,发生的反应为GeO2+2NaOH═Na2GeO3+H2O、As2O3+2NaOH═2NaAsO2+H2O,向溶液中加入NaClO3氧化除砷,发生的反应为3NaAsO2+NaClO3+6 NaOH=3 Na3AsO4+NaCl+3H2O,向溶液中加入稀盐酸并蒸馏,“蒸馏”过程中的反应为:Na2GeO3+6HCl═2NaCl+GeCl4+3H2O,所以得到GeCl4,向GeCl4中加入高纯水,发生的水解反应为GeCl4+(n+2)H2O=GeO2•n H2O↓+4HCl,然后过滤得到母液和GeO2•n H2O,将GeO2•n H2O烘干得到高纯的GeO2,
(1)锗的原子序数为32,锗在元素周期表中的位置为第四周期IVA族,故答案为:四;IVA;
(2)“氧化除砷”的过程是将NaAsO2氧化为Na3AsO4,同时氯酸钠被还原生成氯化钠,根据反应物和生成物书写反应方程式为3NaAsO2+NaClO3+6 NaOH=3 Na3AsO4+NaCl+3H2O,
故答案为:3NaAsO2+NaClO3+6 NaOH=3 Na3AsO4+NaCl+3H2O;
(3)传统的提纯方法是将粗品直接加入盐酸中蒸馏,其缺点是馏出物中将会含有AsCl3,降低了产品纯度,故答案为:馏出物中将会含有AsCl3,降低了产品纯度;
(4)工业上与蒸馏操作相关的设备有蒸馏釜和冷凝塔,故选AC;
(5)“水解”时生成GeO2•n H2O和HCl,反应方程式为GeCl4+(n+2)H2O=GeO2•n H2O↓+4HCl,该水解反应为放热反应,温度较低时反应平衡常数较大,反应物平衡转化率更高;或温度高时GeCl4易挥发降低产率,所以采用低温水解,
故答案为:GeCl4+(n+2)H2O=GeO2•n H2O↓+4HCl;该水解反应为放热反应,温度较低时反应平衡常数较大,反应物平衡转化率更高;或温度高时GeCl4易挥发降低产率;
(6)1吨二氧化锗粗品(含杂质30%)中杂质质量=1t×30%=0.3t,纯的二氧化锗质量=1t×(1-30%)=0.7t,实际上经提纯得0.745吨的高纯二氧化锗产品,则提纯得到的二氧化锗中杂质质量=(0.745-0.7)t=0.045t,杂质去除率=$\frac{(0.3-0.045)t}{0.3t}$×100%=85%,
故答案为:85%.
点评 本题考查物质制备,为高频考点,涉及元素周期表结构及其应用、盐类水解、氧化还原反应等知识点,明确化学反应原理、基本操作、物质性质是解本题关键,知道流程图中发生的反应及基本操作方法,侧重考查学生知识综合应用能力,题目难度中等.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 氟化铵的电子式: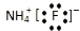 | |
| B. | 原子最外层只有1个电子的元素一定是金属元素 | |
| C. | 离子结构示意图: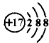 ,可以表示35Cl-,也可以表示37Cl- ,可以表示35Cl-,也可以表示37Cl- | |
| D. | 1mol CH4与1mol NH4+所含质子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 透明的溶液中:Al3+、Cu2+、SO42-、NO3- | |
| B. | 通入SO2的溶液中:Fe3+、Ba2+、Cl-、NO3- | |
| C. | 加入铝粉产生H2的溶液中:NH4+、Fe3+、SO42-、NO3- | |
| D. | 常温下,由水电离出的c(H+)=1×10-12mol/L:K+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为8、中子数为10的氧原子:${\;}_{16}^{8}$O | |
| B. | 过氧化氢的电子式: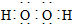 | |
| C. | 氧原子的价电子排布图: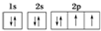 | |
| D. | 次氯酸的结构式:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
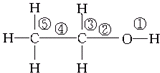
| A. | 与金属钠反应,键①断裂 | |
| B. | 在Ag或Cu催化作用下和O2反应,键②和键③断裂 | |
| C. | 和浓硫酸共热,在170℃时发生消去反应时键②和⑤断裂 | |
| D. | 乙醇和乙酸在浓硫酸作用下加热时发生反应,键①断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
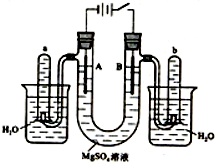 如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色.(指示剂的pH变色范围:6.8~8.0,酸色-红色,碱色-黄色)回答下列问题:
如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色.(指示剂的pH变色范围:6.8~8.0,酸色-红色,碱色-黄色)回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
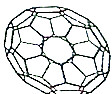 目前,化学家们已经找到十余种富勒烯家族的Cn,它们分子结构中都由正五边形和正六边形构成的封闭的凸多面体,C60就是其中的一种富勒烯,其结构如图所示,下列物质不属于富勒烯家族的是( )
目前,化学家们已经找到十余种富勒烯家族的Cn,它们分子结构中都由正五边形和正六边形构成的封闭的凸多面体,C60就是其中的一种富勒烯,其结构如图所示,下列物质不属于富勒烯家族的是( )| A. | C28 | B. | C44 | C. | C70 | D. | C105 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2能与金属活动性顺序表中大多数金属反应 | |
| B. | N2是大气中的主要成分之一,雷雨时可直接转化为NO2 | |
| C. | 硫是一种黄色的能溶于水的晶体,既有氧化性又有还原性 | |
| D. | 浓硫酸可以干燥Cl2,但不能干燥SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com