
锗(第四周期第ⅣA族)和铝在周期表中位于对角线位置,两者性质很相似.下列关于锗和锗的化合物性质推断正确的是 ( )
A.锗不能与强碱溶液反应 B.氢氧化锗有两性
C.氧化锗易溶于水 D.氧化锗的化学式为Ge2O3
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:实验题
某化学小组设计如下装置,探究铜和一定量的浓HNO3是否反应是否有NO生成。已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油。

请回答下列问题:
(1)加入浓HNO3前应先通一段时间N2,具体操作为:______,其作用是_______。
(2)关闭K1、K2,打开K3,通过分液漏斗向试管中加入一定量的浓硝酸,然后在硝酸上方加一层煤油,煤油的作用是_____,待铜和硝酸反应完毕后,通过分液漏斗向试管中加煤油直至试管充满。
(3)读取量气管读数时,要先________,然后再读取读数。
(4)数据分析:① 从B中取20mL溶液,恰好中和用去0.lmol/L的NaOH体积为16mL则B中所得硝酸的物质的量浓度为_______。
② 假设只生成NO2,通过计算理论上收集到的气体体积为_______mL (标准状况下)。
③ 实验最终测得气体的体积为130.5mL(标准状况下),与理论值有差异,其理由可能为______。
A.Cu与一定物质的量浓度的HNO3反反应除了生成NO2还生成NO
B.过程中还发生了反应4NO+3O2+2H2O=4HNO3
C.过程中还发生了反应4NO2+O2+2H2O=4HNO3
D.硝酸具有挥发性,对实验有影响
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一下学期期中化学试卷(解析版) 题型:选择题
下列相关关系正确的是( )
A.热稳定性:H2O>HF>H2S
B.原子半径:Na>Mg>O
C.酸性:H3PO4>H2SO4>HClO4
D.离子半径:Cl->S2->K+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二下学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.煤的干馏和石油的分馏都是物理变化
B.1-氯丙烷和2-氯丙烷的消去产物相同
C.正戊烷、异戊烷、新戊烷的沸点逐渐升高
D.利用油脂在酸性条件下水解,可以生产甘油和肥皂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省龙海市高一下学期期中化学试卷(解析版) 题型:填空题
已知A、B、C、D、E、G、H、I均为气体,G可使湿润红色石蕊试纸变蓝,
J为常见的液态物质,A、B、C、I、M为单质,且M为常见金属,G和H相遇时产生白烟,它们存在如下的转化关系(图中部分反应物或产物已省略),请回答有关问题:
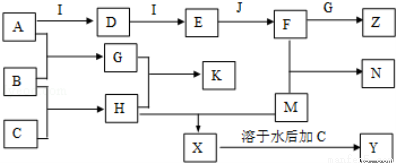
(1)请写出:A物质的化学式:________, K物质的名称: ________,
例举F物质的一种用途__________________________________;
(2)①写出实验室用K制取G的化学方程式_____________________________;
②实验室检验气体G是否收集满的方法: __________________________
____________________________________________________________;
③G与H相遇可生成白烟K,请写出该反应的化学方程式 。
(3)①F的浓溶液与木炭反应的化学方程式为__________________________________;
②工业F的浓溶液呈黄色,试用化学方程式解释原因:________________________;
若要消除黄色可向其中通入一定量的____________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省龙海市高一下学期期中化学试卷(解析版) 题型:选择题
用一种试剂可鉴别NH4Cl,K2SO4,(NH4)2SO4,AlCl3、FeCl3五瓶溶液,该试剂是( )
A.Ba(OH)2 B.KSCN C. NaOH D. BaCl2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省龙海市高一下学期期中化学试卷(解析版) 题型:选择题
喷泉实验是一种常见的自然现象,其产生原因是存在压强差。在上图右图中的锥形 瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是 ( )

A.Cu与稀盐酸 B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省龙海市高二下学期期中化学试卷(解析版) 题型:选择题
已知正丁烷、异丁烷燃烧的热化学方程式分别为:CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) △H=-2878kJ ·mol-1
(CH3)2CHCH3(g)+6.5O2(g) →4CO2(g)+5H2O(l) △H=-2869kJ· mol-1
则下列说法正确的是()
A.正丁烷的燃烧热大于异丁烷,故正丁烷分子中的碳氢键比异丁烷的多
B.正丁烷的稳定性大于异丁烷
C.正丁烷转化为异丁烷的过程是一个放热过程
D.正丁烷分子储存的能量小于异丁烷分子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二下学期期中化学试卷(解析版) 题型:实验题
实验室制备1,2-二溴乙烷的反应原理如下:
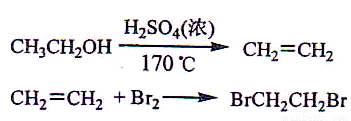
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
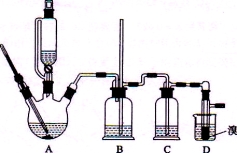
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示:
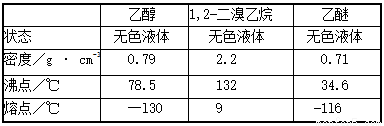
有关数据列表如下:
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收A中反应可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用 的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com