
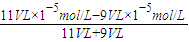 =10-6mol/L,则pH=8,故答案为:8;
=10-6mol/L,则pH=8,故答案为:8; NH3?H2O+H+,水解呈酸性,
NH3?H2O+H+,水解呈酸性,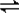 NH3?H2O+H+;
NH3?H2O+H+;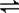 NH4++NH2-,在液氨中加入NH4Cl,NH4+浓度增大,则平衡向逆反应方向移动,
NH4++NH2-,在液氨中加入NH4Cl,NH4+浓度增大,则平衡向逆反应方向移动,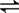 NH4++NH2-;逆反应方向;
NH4++NH2-;逆反应方向;

科目:高中化学 来源: 题型:
2- 4 |
2- 3 |
| 滴入A溶液 |
| 再加A溶液 |
| 滴入A溶液 |
| 再加A溶液 |
| 滴入A溶液 |
| 再加A溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成




查看答案和解析>>
科目:高中化学 来源: 题型:
 (X为卤素原子)
(X为卤素原子) 的物质,该物质是一种香料.
的物质,该物质是一种香料.


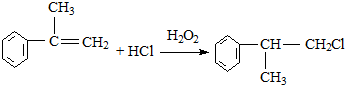
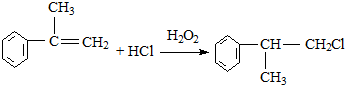


查看答案和解析>>
科目:高中化学 来源: 题型:
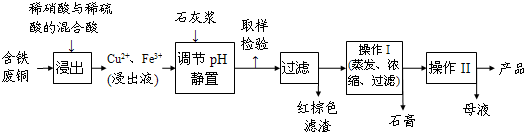
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 实验小组 | 称取CuSO4 的质量(g) |
装置C增加 的质量(g) |
量筒中水的体积折算成标 准状况下气体的体积(mL) |
| 一 | 6.4 | 2.56 | 298.7 |
| 二 | 6.4 | 2.56 | 448 |
| ||
| ||
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com