
| A. | 石油分馏是物理变化,可获得汽油、煤油、柴油等产品 | |
| B. | C4H9Cl、C4H8Cl2的同分异构体种类分别有4种、9种(不含立体异构) | |
| C. | 淀粉和纤维素水解的最终产物不同 | |
| D. | 由乙酸生成乙酸乙酯属于取代反应 |
分析 A.分馏与混合物的沸点有关;
B.丁基有4种,结合“定一移二”法分析二取代物;
C.淀粉和纤维素均为多糖;
D.乙酸与乙醇发生酯化反应生成乙酸乙酯.
解答 解:A.分馏与混合物的沸点有关,则石油分馏是物理变化,可获得汽油、煤油、柴油等产品,故A正确;
B.丁基有4种,C4H9Cl有4种,C4H8Cl2的同分异构体可以采取“定一移二”法为 ,由可知C4H8Cl2共有9种同分异构体,故B正确;
,由可知C4H8Cl2共有9种同分异构体,故B正确;
C.淀粉和纤维素均为多糖,水解的最终产物为葡萄糖,故C错误;
D.乙酸与乙醇发生酯化反应生成乙酸乙酯,醇中H被取代,为取代反应,故D正确;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的难点,题目难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 碱金属元素锂、钠、钾、铷、铯,随着核电荷数的增加其单质的熔沸点逐渐降低 | |
| B. | 卤族元素氟、氯、溴、碘,随着核电荷数的增加其单质的熔沸点逐渐升高 | |
| C. | NaOH、KOH、Mg(OH)2的碱性依次减弱 | |
| D. | 在周期表中金属与非金属的分界处可以找到半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钠硫电池是一种新型可充电电池,它以熔融的金属钠作为电极的反应物,以熔融的硫和多疏化钠(Na2Sx,熔融状态下可电离出Na,和S42-的混合物作一个电极的反应物,以固体Al2O3陶瓷(可传导Na,但不能传导阴离子)为电解质,电池总反应为2Na+xS═Na2Sx.工作原理如图所示:
钠硫电池是一种新型可充电电池,它以熔融的金属钠作为电极的反应物,以熔融的硫和多疏化钠(Na2Sx,熔融状态下可电离出Na,和S42-的混合物作一个电极的反应物,以固体Al2O3陶瓷(可传导Na,但不能传导阴离子)为电解质,电池总反应为2Na+xS═Na2Sx.工作原理如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
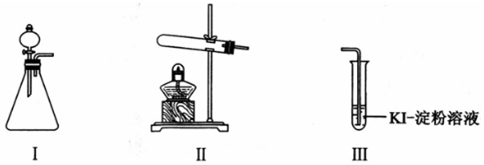
| 操作 | 现象 | |
| 甲 | 向I的锥形瓶中加入MnO2固体,.向I的分液漏斗中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
| 丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
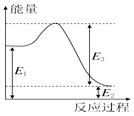 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
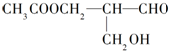 在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性,下面的物质有光学活性:发生下列反应后生成的有机物无光学活性的是( )
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性,下面的物质有光学活性:发生下列反应后生成的有机物无光学活性的是( )| A. | 与甲酸发生酯化反应 | B. | 与新制的氢氧化铜作用 | ||
| C. | 与银氨溶液作用 | D. | 在催化剂存在下与H2作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com