
| A. | OH-的物质的量相同 | B. | H+ 物质的量浓度相同 | ||
| C. | OH-的物质的量浓度不同 | D. | H+的物质的量浓度不同 |
分析 一水合氨为弱碱,则pH相等的氨水和NaOH溶液中:c(氨水)>c(NaOH),
A.pH相同时溶液中氢离子浓度一定相同;
B.溶液的pH相同,则溶液中氢氧根离子浓度相同;
C.两溶液的pH相同,则氢氧根离子、氢离子浓度相同;
D.两溶液中氢离子浓度一定相同.
解答 解:一水合氨为弱碱,则pH相等的氨水和NaOH溶液中:c(氨水)>c(NaOH),
A.物质的量与溶液体积有关,没有告诉溶液体积,无法计算氢氧根离子的物质的量,故A错误;
B.根据pH=-lgc(H+)可知,pH相同时溶液中H+物质的量浓度相同,故B正确;
C.pH相同的氨水和氢氧化钠两种溶液中OH-的物质的量浓度一定相同,故C错误;
D.由于溶液的pH相同,则两溶液中氢离子浓度一定相同,故D错误;
故选B.
点评 本题考查了弱电解质的电离、离子浓度大小比较,题目难度中等,明确弱电解质的电离特点为解答结构,注意掌握影响电离平衡的因素,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
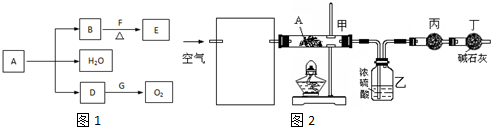
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. (只写一种)
(只写一种)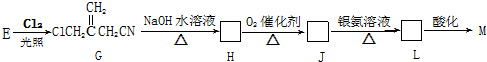


 (实例如图1);第二步反应试剂及条件限用NaOH水溶液、加热)
(实例如图1);第二步反应试剂及条件限用NaOH水溶液、加热)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中的OH-向负极移动 | |
| B. | 在银表面上的反应为:Ag2S+2e-═2Ag+S2- | |
| C. | 在铝表面的反应为:Al-3e-═Al3+ | |
| D. | 在铝表面的反应为:Al+4OH--3e-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠可用于泡沫灭火剂 | B. | 明矾能做净水剂 | ||
| C. | 氯气可作自来水消毒剂 | D. | 铝热反应可用来焊接钢轨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
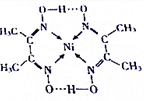 从物质结构决定性质的视角可预测物质的有关性质.回答下列有关问题:
从物质结构决定性质的视角可预测物质的有关性质.回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焓变是指在恒压、恒温下,体系不做体积功,只做其它功的变化过程的热效应 | |
| B. | 书写热化学方程式时若不标明温度和压强,则表示是在0℃、101kpa条件下的反应热 | |
| C. | 化学反应中的能量变化,是由化学反应中化学键断裂时吸收的能量与生成物中化学键形成时放出的能量不同所导致的 | |
| D. | 吸热反应的△H<0,放热反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 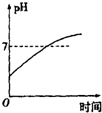 | B. | 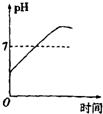 | C. | 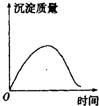 | D. | 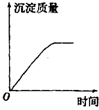 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
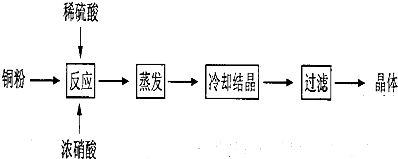
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com