
(1)下面是用98%的浓H2SO4(ρ=1.84 g/cm3)配制成0.5 mol·L-1的稀H2SO4 500 mL的操作,请按要求填空:
①所需浓H2SO4的体积为________;
②如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL的量筒最好;
③将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100 m L水的烧杯里,并不断搅拌,目的是________________________;
L水的烧杯里,并不断搅拌,目的是________________________;
④将________的上述溶液沿________注入________中,并用50 mL蒸馏水洗涤烧杯2~3次,洗涤液要一并注入上述容器中,并摇匀;
⑤加水至距刻度线1~2 cm时,改用________加水,使溶液的凹液面正好跟刻度线相切。
(2)某同学在配制NaOH溶液时有以下现象发生,则对所配溶液的物质的量浓度有何影响?(填“ 偏高”、“偏低”或“不变”)
偏高”、“偏低”或“不变”)
①定容时观察液面俯视________;
②NaOH颗粒表面部分变质________;
③用胶头滴管向容量瓶中加水时凹面高于刻度线,此时立即用胶头滴管将瓶内液体吸出,使凹液面与刻度线相切________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
推断溶液中所含有的离子,一般根据题目中描述的实验现象,依据常见离子的检验方法及离子共存的知识进行判断。这类题目综合了元素化合物的大部分知识,同时溶液的颜色、酸、碱性等也渗入其中。
例2、一杯澄清透明的溶液中,已知各离子的浓度均为0.1 mol·L-1 ,体积为1 L。可能含有的离子:阳离子为K+、Fe2+、Ba2+、NH4+,阴离子为Cl-、NO3-、CO32-、SO42-。向该混合液中加足量稀盐酸,有无色气体生成,且阴离子的种类不变。对该溶液的下列叙述错误的是( )
A. 该溶液一定含有Fe2+、NO3-、Cl-
B. 该溶液一定不含K+、NH4+
C. 该溶液一定不含CO32-、Ba2+
D. 该溶液可能含有SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是( )
A.MnO2 与浓盐酸反应制Cl2:MnO2+4HCl Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B.明矾溶于水产生Al(OH)3 胶体:Al3++3H2O === Al(OH)3↓+3H+
C.Na2O2 溶于水产生O2:Na2O2+H2O === 2Na++2OH-+O2↑
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3- +Ca2++OH-=== CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应对应的离子方程式书写正确的是 ( )。
A.漂白粉露置在空气中失效:ClO-+CO2+H2O=HClO+HCO
B.氢氧化钡溶液与硫酸氢钠溶液反应后溶液恰好为中性:
Ba2++H++SO +OH-=BaSO4↓+H2O
+OH-=BaSO4↓+H2O
C.Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑
D.在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4,
4OH-+3ClO-+2Fe(OH)3=2FeO +3Cl-+5H2O
+3Cl-+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L二氯甲烷的分子数约为NA个
B.盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol
C.17.6 g丙烷中所含的极性共价键为4NA个
D.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g
查看答案和解析>>
科目:高中化学 来源: 题型:
含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50mg,则
A.被氧化的砒霜为1.98mg
B.分解产生的氢气为0.672ml
C.和砒霜反应的锌为3.90mg
D.转移的电子总数为6×10—5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为( )
A.9.0L B.1 3.5L C.15.7L D.16.8L
3.5L C.15.7L D.16.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
对于碳及其化合物间转化的说法中,正确的是( )
A.大气中CO2含量的剧增,对自然界中碳及其化合物间的平衡没有影响
B.木炭燃烧过程中,存在碳单质、CO和CO2之间的转化
C.碳的氧化物间的相互转化不属于氧化还原反应
D.含碳的无机化合物和有机化合物之间存在着严格的界限,无机化合物不能合成有机化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
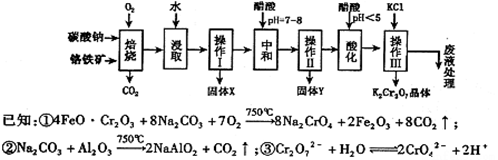
根据题意回答下列问题:
(1)操作Ⅰ的名称是 ,固体X中主要含有 (填写化学式);
(2)用醋酸调节溶液pH=7~8后再进行操作Ⅱ所得固体Y的成分为 (写化学式).
(3)酸化步骤中调节溶液pH<5时发生反应2CrO42-+2H+ 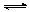 Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为 .
Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为 .
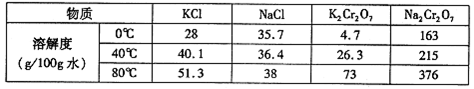
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是
Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是: 。
(5)含铬废渣(废水)的随意排放对人类生存环境有极大的危害。电解法是处理铬污染的一种方法,金属铁作阳极、石墨作阴极电解含Cr2O72-的酸性废水,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。
 ①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3): n (H2)=1:1)
①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3): n (H2)=1:1)
___Fe+___Cr2O72-+___ +___H2O =___Fe(OH)3↓+___Cr(OH)3↓+___H2↑;
②已知常温下Cr(OH)3的Ksp=6.4×10–32mol4/l4,若Ⅰ类生活饮用水水质标准铬含量最高限值是0.052 mg/L,要使溶液中c(Cr3+)降到符合饮用水水质标准,须调节溶液的pH大于______。
(已知lg2=0.3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com