某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中的溶解程度进行研究.在25℃时,弱酸HA在水中部分电离,当HA浓度为3.0×10
-3mol?L
-1时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)
2.该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)
B/C(HA)
W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
| 25℃平衡体系(苯、水HA) | 平衡常数 | 焓变 | 起始总浓度 |
| 在水中,HA?H++A- | K1 | △H1 | 3.0×10-3mol?L-1 |
| 在苯中,2HA?(HA)2 | K2 | △H2 | 4.0×10-3mol?L-1 |
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K
1=
.
(2)25℃,该水溶液的pH为
,(已知:1g2=0.3,lg3=0.5)在苯体系中HA的转化率为
.
(3)在苯中,HA发生二聚:2HA?(HA)
2,反应在较低温度下自发进行,则△H
2
0.
(4)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足
=130,则反应向
方向进行.
(5)在25℃时,用0.1000mol/L氢氧化钠溶液滴定20.00mL 0.1000mol/L HA水溶液的大致滴定曲线示意图正确的是
.
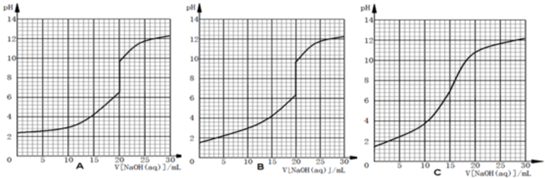
(6)根据你所选定的滴定曲线图,在滴定过程中下列说法正确的是
A.当加入氢氧化钠溶液10.00mL的溶液中:c(A
-)+c(OH
-)=c(HA)+c(H
+)
B.在pH=7的溶液中:c(Na
+)=c(HA)+c(A
-)
C.在恰好完全反应的溶液中:c(Na
+)>c(A
-)>c(OH
-)>c(H
+)
D.滴定过程中可能出现:c(HA)>c(A
-)>c(H
+)>c(Na
+)>c(OH
-)




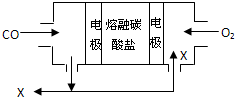 用熔融碳酸盐作电解质,CO、O2为原料组成的新型燃料电池如图所示,为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参与循环.下列说法错误的是( )
用熔融碳酸盐作电解质,CO、O2为原料组成的新型燃料电池如图所示,为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参与循环.下列说法错误的是( )