
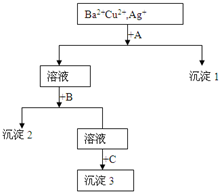
 某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图所示
某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图所示

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.
合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用浓盐酸跟二氧化锰反应制取Cl2 |
| B、用浓氨水和生石灰制取NH3 |
| C、用电石跟水反应制取C2H2 |
| D、用浓硝酸跟铜反应制取NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
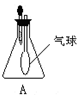 使用装置A进行实验时,将滴管中的液体加入到锥形瓶中,发现气球鼓起来.试推测锥形瓶中的气体和滴管中的物质可能为( )
使用装置A进行实验时,将滴管中的液体加入到锥形瓶中,发现气球鼓起来.试推测锥形瓶中的气体和滴管中的物质可能为( )| A、Cl2和饱和食盐水 |
| B、NO和水 |
| C、O2和水 |
| D、SO2和NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子最外层电子排布式为nsnnpn |
| Y | Y是空气中含量最高的元素 |
| Z | Z是地壳中含量最高的金属元素 |
| W | W的单质是常见的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com