
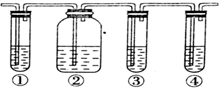
分析 确认反应生成的气体中有乙烯和SO2,二者均与溴水反应,由实验装置可知,①中Wie品红,品红褪色可说明含SO2,②中NaOH溶液除去SO2,③中品红检验SO2除尽,④中为溴水,溴水褪色可说明含乙烯,以此来解答.
解答 解:确认反应生成的气体中有乙烯和SO2,二者均与溴水反应,由实验装置可知,①中Wie品红,品红褪色可说明含SO2,②中NaOH溶液除去SO2,③中品红检验SO2除尽,④中为溴水,溴水褪色可说明含乙烯,
(1)由上述分析可知,①-④装置中所盛放的试剂(可重复)依次是品红、NaOH溶液、品红、溴水,
故答案为:品红、NaOH溶液、品红、溴水;
(2)确认有乙烯存在的现象是③中的品红不褪色,④中的溴水褪色,
故答案为:③中的品红不褪色,④中的溴水褪色;
(3)装置④中发生反应的化学方程式为CH2=CH2+Br2→CH2Br-CH2Br,
故答案为:CH2=CH2+Br2→CH2Br-CH2Br.
点评 本题考查性质实验方案的设计,为高频考点,把握实验装置的作用、物质的检验和发生的反应和现象为解答的关键,侧重分析与实验能力的考查,注重元素化合物与实验结合的训练,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为235 | B. | 质子数是235 | ||
| C. | 中子数为92 | D. | 与23892U是同种原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示的装置中,M为活动性顺序表中位于氢之前的金属,N为石墨棒,关于此装置的下列叙述中,不正确的是( )
如图所示的装置中,M为活动性顺序表中位于氢之前的金属,N为石墨棒,关于此装置的下列叙述中,不正确的是( )| A. | 导线中有电流通过,电流方向是由N到M | |
| B. | N上有气体放出 | |
| C. | M为正极,N为负极 | |
| D. | 是化学能转变为电能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
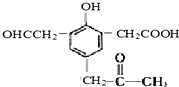 ,试回答:
,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝表面有一层致密的氧化物薄膜,故铝制容器可用来腌制咸菜等 | |
| B. | 如果发生氯气泄漏,附近人员应迅速远离液氯泄漏地点,并顺风往低洼区域疏散 | |
| C. | “低碳生活”倡导生活中尽量减少耗能,从而减少CO2排放 | |
| D. | 向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物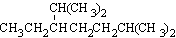 的名称为2,6-二甲基-5-乙基庚烷 的名称为2,6-二甲基-5-乙基庚烷 | |
| B. | 苯和油脂均不能使酸性KMnO4溶液褪色 | |
| C. | 有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.7%,则能在碱性溶液中发生反应的X的同分异构体有(不考立体异构)13种 | |
| D. | 检验卤代烃中的卤素原子种类的方法是:加入NaOH溶液共热,再加AgNO3溶液,观察沉淀颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com