
【题目】写出下列反应的离子方程式。
(1)向Na2S2O3溶液中加入稀硫酸_____________________________________________________________
(2)在Mg(OH)2悬浊液中加入FeCl3溶液,沉淀变为红褐色____________________________________
(3)Mg(OH)2沉淀溶于NH4Cl溶液中______________________________________________________
【答案】 S2O32-+ 2H+=S↓+ SO2↑+ H2O 3Mg(OH)2(s)+ 2Fe3+(aq) ![]() 2Fe (OH)3(s)+ 3Mg2+(aq) Mg(OH)2+2NH4+ =Mg2++2NH3·H2O
2Fe (OH)3(s)+ 3Mg2+(aq) Mg(OH)2+2NH4+ =Mg2++2NH3·H2O
【解析】(1)向Na2S2O3溶液中加入稀硫酸生成硫酸钠、单质硫、二氧化硫和水,离子方程式为S2O32-+2H+=S↓+SO2↑+H2O;(2)在Mg(OH)2悬浊液中加入FeCl3溶液,沉淀变为红褐色,说明氢氧化镁转化为更难溶的氢氧化铁沉淀,方程式为3Mg(OH)2(s)+2Fe3+(aq)![]() 2Fe(OH)3(s)+3Mg2+(aq);(3)Mg(OH)2沉淀溶于NH4Cl溶液中生成氯化镁和一水合氨,方程式为Mg(OH)2+2NH4+=Mg2++2NH3·H2O。
2Fe(OH)3(s)+3Mg2+(aq);(3)Mg(OH)2沉淀溶于NH4Cl溶液中生成氯化镁和一水合氨,方程式为Mg(OH)2+2NH4+=Mg2++2NH3·H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(1)现有下列六种物质:SO2、SiO2、CaO、MgO、Fe2O3、Na2O2,按照不同的分类标准,它们中有一种物质与其他五种有明显的不同,请找出这种物质,并写出分类的依据(至少要写出两种分类方法)。
①________________________________________________________________________;
②________________________________________________________________________。
(2)从反应中有无离子参加,可以将化学反应分为离子反应和非离子反应。Na2O2与水反应的离子方程式是________。从反应中________,可以将化学反应分为氧化还原反应和非氧化还原反应,从上述物质中分别找出两种能相互反应的物质,各写一个非氧化还原反应的方程式和氧化还原反应的方程式:________________________________________________________________________。
(3)虽然分类的方法不同,但离子反应和氧化还原反应之间也存在着一定的关系,请用简单的图示方法表示二者之间的关系___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生下列反应,其中属于盐类水解反应的是
A. NH4+ + 2H2O![]() NH3·H2O + H3O+ B. HCO3-+H2O
NH3·H2O + H3O+ B. HCO3-+H2O![]() H3O+ + CO32-
H3O+ + CO32-
C. HS- + H3O+ ![]() H2S + H2O D. Cl2 + H2O
H2S + H2O D. Cl2 + H2O ![]() H+ + Cl- + HClO
H+ + Cl- + HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的图解表示构成生物体的元素、化合物及其作用,其中a、b、d、e代表小分子,A、B、E、F代表不同的分子量较大的物质,请据图回答下列问题:
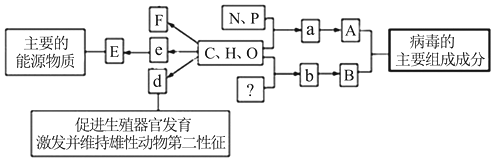
(1)e是细胞中主要的能源物质,被人称为“生命的燃料”,则e是___,E在植物细胞中主要是指_________,E在人体中主要分布于 ______ 细胞。
(2)在HIV(人类免疫缺陷病毒)中物质A的中文名称是___________,其基本组成单位a有______种。
(3)物质d是______;物质F是______,并且由于其储存能量多而且所占体积小,是生物体内重要的储能物质。等质量的物质F与物质E相比,物质F储存的能量多,从元素的含量上看,原因是 _____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中所含氢原子个数与3.2g O2 所含的分子数相同的是( )
A. 0.2gNH3 B. 0.1mol HCl分子
C. 6.02×1023个H2SO4分子 D. 标准状况下1.12L CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)含氢原子8g的CH4所含原子总数是标况下____升H2所含原子总数的二倍。
(2)标况下,W g CO2与4.48 LH2的混合气体的总体积等于32g CH4的体积,求W=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
Ⅰ.ZnSO4溶液的制备与提纯:

有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)若②中加入氧化剂为H2O2,写出离子反应方程式____________________________________。
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤______(选填①、②、③、⑤)。
(3)滤渣2的主要成分为_______________________________。
(4)写出步骤④后产生滤渣3的离子反应方程式______________________________。
(5)滤液3中含碳粒子浓度大小的顺序为______________________________________。
Ⅱ.BaS溶液的制备:
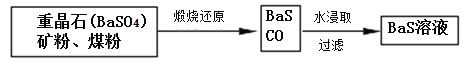
(6)写出煅烧还原的化学反应方程式__________________________________。
BaSO4和BaCO3的KSP相当,解释为什么BaCO3可溶于盐酸中而BaSO4难溶___________________。
Ⅲ.制取锌钡白:
(7)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2X为二元弱酸,常温下,0.1 mol/L的NaHX溶液中c(H+) > c(OH-),下列关系中一定正确的是
A. c(Na+) + c(H+) = c(HX-) + 2c(X2-) B. c(H+)·c(OH-) = 10-14 mol2·L-2
C. c(Na+) = c(X2-) + c(HX-) D. 溶液中pH = 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)49 g H2SO4的物质的量是________;1.5 mol H2SO4的质量是_______,其中含有_______ mol H,含有_______g O。
(2)摩尔质量是指单位物质的量的物质所具有的质量。
①已知NH3的相对分子质量为17,则NH3的摩尔质量为________。
②NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为________。
③已知一个铁原子的质量为b g,则铁原子摩尔质量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com