
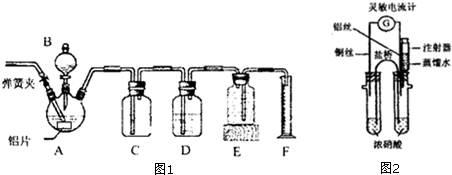
分析 (1)根据仪器的构造可知仪器名称为三颈烧瓶,通一段时间的氮气,其目的为排净体系内的空气,防止对气体产物的检验造成干扰;
(2)稀硝酸与金属铝反应产生无色气体为NO,铝在常温下遇到浓硝酸会发生钝化,由于装置内部有氮气,故同样可以观察到C中气体仍然为无色,D中导气管口也有气泡冒出;
(3)铜失电子做负极,指针偏转会指向铜,正极是溶液中硝酸根离子得到电子发生还原反应,电极反应为:NO3-+e-+2H+═NO2↑+H2O,使铁钝化的硝酸最低浓度=$\frac{5.0×1.4×65%}{5.0×1.4+2.5}$×100%=47.9%.
解答 解:(1)根据仪器的构造可知仪器名称为三颈烧瓶,通一段时间的氮气,其目的为排净体系内的空气,若有空气会对产生气体的检查产生干扰,故目的为排净体系内的空气,防止对气体产物的检验造成干扰,
故答案为:三颈烧瓶;排净体系内的空气,防止对气体产物的检验造成干扰;
(2)稀硝酸与金属铝反应产生无色气体为NO,N的化合物价降低,铝的化合物价升高,根据氧化还原方程式书写方法书写,其离子方程式为Al+4H++NO3-=Al3++NO↑+2H2O;铝在常温下遇到浓硝酸会发生钝化,生成致密的氧化膜,由于装置内部有氮气,故同样可以观察到C中气体且仍然为无色,D中导气管口也有气泡冒出,这是因为当加入20ml 浓硝酸时就会排出20ml氮气,此实验不能说明浓硝酸、稀硝酸与金属铝反应生成相同的气体产物,
故答案为:Al+4H++NO3-=Al3++NO↑+2H2O;否;当加入20ml 浓硝酸时就会排出20ml氮气;
(3)铜失电子做负极,指针偏转由正极指向负极,会指向铜;正极是溶液中硝酸根离子得到电子发生还原反应,电极反应为:NO3-+e-+2H+═NO2↑+H2O,用盛蒸馏水的注射器缓慢向具支试管内加水,相当与稀硝酸的反应,电流表的指针再次指向铜,使铁钝化的硝酸最低浓度=$\frac{5.0×1.4×65%}{5.0×1.4+2.5}$×100%=47.9%,
故答案为:铜;NO3-+e-+2H+═NO2↑+H2O;电流表的指针再次指向铜;47.9%.
点评 本题考查了浓、稀硝酸与金属铝反应的异同,为物质的性质实验探究题,弄清实验原理是解题的关键,注意铝在常温下在浓硝酸中的钝化,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | FeO | B. | Fe2O3 | C. | Fe3O4 | D. | FeO和Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中Fe2+是还原剂,O2是还原产物 | |
| B. | 4 mol Na2O2在反应中共得到8NA个电子 | |
| C. | 每生成0.2 mol O2,则被Fe2+还原的氧化剂为0.4 mol | |
| D. | 反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -824.4kJ•mol-1 | B. | -627.6kJ•mol-1 | C. | -744.7kJ•mol-1 | D. | -169.4kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铅蓄电池在充电过程中,正、负极质量都增大 | |
| B. | 反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 | |
| C. | NH3•H2O溶液加水稀释后,溶液中$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$的值减小 | |
| D. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 电离能序号 | I1 | I2 | I3 | I4 |
| 电离能(kJ/mol) | 740 | 1500 | 7700 | 10500 |
| A. | s区 | B. | p区 | C. | d区 | D. | ds区 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com