
| A. | 分馏石油时,温度计的水银球必须插入液面以下 | |
| B. | 制备乙酸乙酯时,加料顺序为浓硫酸、乙醇、乙酸 | |
| C. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加,直至沉淀刚好溶解为止 | |
| D. | 实验室可用苯和溴水在Fe作催化剂的情况下制备溴苯 |
分析 A、温度计测量馏分的温度;
B、制取混合酸时,需要类比浓硫酸的稀释进行操作,应该将浓硫酸加入到乙醇中;
C、氨水和硝酸银反应生成AgOH,AgOH继续与氨水反应生成银氨络离子;
D、溴水和苯不反应,制取溴苯需要的是液溴,据此解答即可.
解答 解:A、实验室进行石油的分馏实验时,是利用物质的沸点不同分离混合物,所以温度计测量馏分的温度,水银球位于支管口处,故A错误;
B、浓硫酸溶于水放出大量的热,且密度比水大,为防止酸液飞溅,应先在烧瓶中加入一定量的乙醇和乙酸,然后慢慢将浓硫酸加入烧瓶,边加边振荡,不能先加入浓硫酸再加入乙醇和乙酸,故B错误;
C、氨水和硝酸银反应生成AgOH,AgOH继续与氨水反应生成银氨络离子,符合操作,故C正确;
D、溴水和苯不反应,应利用液溴与苯在催化剂作用下发生取代反应生成溴苯,故D错误,故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物的分离提纯、物质检验、有机物的制备实验和水解实验等,侧重物质性质及实验技能的考查,注意实验的评价性分析,题目难度不大.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 431 kJ•mol-1 | B. | 945.6 kJ•mol-1 | C. | 649 kJ•mol-1 | D. | 896 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
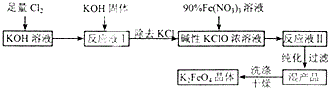 高铁酸钾(K2FeO4)是一种新型多功能水处理剂.其生产工艺如下:
高铁酸钾(K2FeO4)是一种新型多功能水处理剂.其生产工艺如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,其褪色原理相同 | |
| B. | Y与乙酸反应生成W的反应类型是取代反应 | |
| C. | Z和Y分子中官能团不同 | |
| D. | W的分子式为C4H8O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| B. | 可以在元素周期表中金属与非金属元素分界线附近寻找合适的半导体材料 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 元素①位于第二周期第ⅣA族 | B. | 气态氢化物的稳定性:⑤>③ | ||
| C. | 元素的最高正化合价:④=② | D. | 最高价氧化物对应水化物酸性:⑤>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下图装置可用于收集某气体并验证该气体的某些化学性质,下列选项正确的是( )
下图装置可用于收集某气体并验证该气体的某些化学性质,下列选项正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | SO2 | 品红溶液 | 溶液褪色 | SO2 有氧化性 |
| B | C2H4 | 溴水 | 溶液褪色 | C2H4能发生加成反应 |
| C | NH3 | 酚酞试液 | 溶液变红 | 氨水具有漂白性 |
| D | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水具有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中一定不含有离子键,离子化合物中可能含有共价键 | |
| B. | 一定条件下,将1 mol N2与3 mol H2充入密闭容器中充分反应可生成2 mol NH3 | |
| C. | 充电电池的化学反应原理是氧化还原反应 | |
| D. | Na2O和Na2O2晶体中阳离子与阴离子个数比均为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com