
| A. | “爆竹声中除旧岁,春风送暖入屠苏.”爆竹爆炸发生的是分解反应 | |
| B. | “甘之如饴”说明糖类均有甜味 | |
| C. | “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化 | |
| D. | “忽闻海上有仙山,山在虚无缥缈间”的海市蜃楼是一种自然现象,与胶体知识有关 |
分析 A.“爆竹声中除旧岁,春风送暖入屠苏”是炸药的爆炸;
B.淀粉和纤维素没有甜味;
C.“玉不琢不成器”只是玉的形状改变;
D.海市蜃楼与光线在空气中的折射有关,而空气属于胶体.
解答 解:A.“爆竹声中除旧岁,春风送暖入屠苏”是炸药的爆炸,属于氧化还原反应,不是分解反应,故A错误;
B.淀粉和纤维素属于糖类,但没有甜味,故B错误;
C.“玉不琢不成器”只是玉的形状改变,是物理变化,故C错误;
D.空气属于胶体,海市蜃楼是光线在延直线方向密度不同的气层中,经过折射造成的结果,故D正确;
故选D.
点评 本题考查物质组成、结构和性质的关系,题目难度不大,明确常见元素及其化合物组成、性质及用途为解答关键,试题培养了学生的灵活应用能力.


 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | “甘之如饴”说明糖类均有甜味 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “霾尘积聚难见路人”,雾霾所形成的气溶胶具有丁达尔效应 | |
| D. | 古剑“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 相关实验 | 试剂 | 现象和结论 |
| ① | 鉴别K2CO3和Na2SO4 | 盐酸、澄清的石灰水 | 产生无色无味气体,能使澄清的石灰水变浑浊的是K2CO3 |
| ② | 鉴别NO2和Br2蒸气 | 湿润的淀粉KI试纸 | 试纸变蓝色的是Br2蒸气 |
| ③ | 鉴别葡萄糖和蔗糖 | 银氨溶液 | 有银镜产生的葡萄糖 |
| ④ | 将装满氯水的圆底烧瓶倒置在有氯水的水槽中,日光照射 | -- | 烧瓶内有气泡产生,说明日光照射导致溶解的Cl2逸出 |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ②③ |
查看答案和解析>>
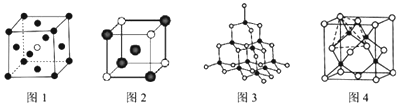
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:填空题
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
(1)Y、Z、W元素的第一电离能由大到小的顺序是 。
(2)K的电子排布式是 。
(3)Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是 。
(4)若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有σ键的数目是 。
(5)Z、K两元素形成的某化合物的晶胞结构如右图所示,则该化合物的化学式是 ,Z原子的配位数是 。

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.2gNO2和N2O4的混合物中含氮原子数目为0.2NA | |
| B. | 常温常压下,35.5g Cl2与足量的NaOH溶液完全反应,转移的电子数为0.5NA | |
| C. | 标准状况下,2.24LNH3与1.6gCH4分子中所含电子数目均为NA | |
| D. | 已知反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,当生成NA个NH3分子时,反应放出的热量小于46.2kJ |
查看答案和解析>>
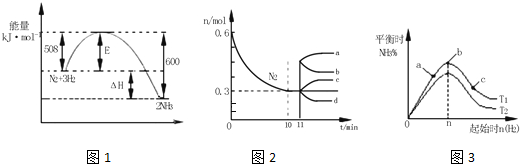
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| 平衡时NH3的浓度(mol•L-1) | cl | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收bkJ | 吸收c kj |
| 体系压强(pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com