
| ѡ�� | ʵ�� | ���ͻ���� |
| A | �ýྻ��Pt˿պȡij��Һ������ɫ��Ӧ������ʻ�ɫ | ����Һ��һ��������K+ |
| B | �ýྻ�IJ����������Na2O2����֬��������֬��ȼ�� | CO2��H2O��Na2O2��Ӧ�Ƿ��ȷ�Ӧ |
| C | ��ij��Һ�еμ������ữ��Ba��NO3��2��Һ������ɫ���� | ����Һ�к���SO42- |
| D | ����һ��ǿ������������Һ�����������ġ�ͨ·���� | ����һ��������ˮ�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
���� A������K+Ӧͨ����ɫ�ܲ�����
B��CO2��H2O��Na2O2��Ӧ�Ƿ��ȷ�Ӧ��
C�����������£��������������������������ӣ�
D�������ЧӦ�ǽ������е����ʣ�
��� �⣺A������ʻ�ɫ��˵������Na+������ɫ�����ڸ��Ϲ⣬Ӧͨ����ɫ�ܲ����۲죬����ȥ�ƹ⣬��A����
B��CO2��H2O��Na2O2��Ӧ�Ƿ��ȷ�Ӧ���ų��������ﵽ��֬���Ż�㣬������֬���Ż𣬹�B��ȷ��
C�����������£��������������������������ӣ���ij��Һ�еμ������ữ��Ba��NO3��2��Һ������ɫ����������������������ӱ����������Ϊ��������ӣ����Ը���Һ�в�һ������SO42-����C����
D������һ��ǿ������������Һ�����������ġ�ͨ·�����������Ķ����ЧӦ��˵���н��壬������һ��������ˮ�������������������壬��D��ȷ��
��ѡBD��
���� ���⿼���Ϊ�ۺϣ��漰��ѧʵ�鷽�������ۣ������ڻ�ѧʵ��������������ʵ����ʵļ����Լ���������ʵ����⣬��Ŀ�ѶȲ���ע����ػ���֪ʶ�Ļ��ۣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ڢۢ� | B�� | �����٢ۢ� | C�� | ����ʢڢ� | D�� | �ǵ���ʢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4 mol | B�� | 3.4 mol | C�� | 2.8 mol | D�� | 1.2 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ʵ��������500mL 0.2mol•L-1��Na2SO4��Һ��ʵ����������У�
ʵ��������500mL 0.2mol•L-1��Na2SO4��Һ��ʵ����������У��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����ͪ����Ҫ����ԭ�ϣ����������������������ͼ��������Ҫ�м��壮ij��ѧ��ȤС�鳢���ô��������Ʊ�����ͪ������ʽΪ��
����ͪ����Ҫ����ԭ�ϣ����������������������ͼ��������Ҫ�м��壮ij��ѧ��ȤС�鳢���ô��������Ʊ�����ͪ������ʽΪ��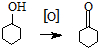
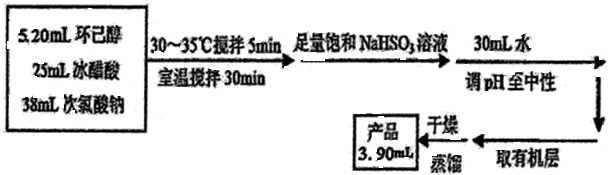
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���������� | ���� | |
| A | ij��Һ�м����Ȼ�����Һ��������ɫ�������ټ���ϡ����������ܽ� | ��Һ��һ������SO42- |
| B | ij��Һ�м�����������Һ��������ɫ���� | ��Һ��һ������Cl- |
| C | �ýྻ��˿պȡij��Һ�ڻ��������գ�����ʻ�ɫ | ��Һ����Na+����K+ |
| D | ��ij��Һ���ȼӼ���KSCN��Һ�������������ٵ���ˮ����Һ��� | ��Һ��һ������Fe2+ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com