

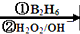 R-CH2CH2OH;
R-CH2CH2OH; ,可推知E为(CH3)2CHCOOH,根据题中各物质转化关系和反应条件可由H反推得G为
,可推知E为(CH3)2CHCOOH,根据题中各物质转化关系和反应条件可由H反推得G为 ,F为
,F为 ,F与氯气发生取代反应生成G,G发生碱性水解,结合信息④得H,由E反推得D为(CH3)2CHCHO,C为(CH3)2CHCH2OH,B发生信息③中的反应,可推知B为CH2=C(CH3)2,结合A的核磁共振氢谱有2种不同化学环境的氢,所以A为(CH3)3COH,A发生消去反应得B,C氧化得D,D氧化得E,据此答题;
,F与氯气发生取代反应生成G,G发生碱性水解,结合信息④得H,由E反推得D为(CH3)2CHCHO,C为(CH3)2CHCH2OH,B发生信息③中的反应,可推知B为CH2=C(CH3)2,结合A的核磁共振氢谱有2种不同化学环境的氢,所以A为(CH3)3COH,A发生消去反应得B,C氧化得D,D氧化得E,据此答题; ,可推知E为(CH3)2CHCOOH,根据题中各物质转化关系和反应条件可由H反推得G为
,可推知E为(CH3)2CHCOOH,根据题中各物质转化关系和反应条件可由H反推得G为 ,F为
,F为 ,F与氯气发生取代反应生成G,G发生碱性水解,结合信息④得H,由E反推得D为(CH3)2CHCHO,C为(CH3)2CHCH2OH,B发生信息③中的反应,可推知B为CH2=C(CH3)2,结合A的核磁共振氢谱有2种不同化学环境的氢,所以A为(CH3)3COH,A发生消去反应得B,C氧化得D,D氧化得E,
,F与氯气发生取代反应生成G,G发生碱性水解,结合信息④得H,由E反推得D为(CH3)2CHCHO,C为(CH3)2CHCH2OH,B发生信息③中的反应,可推知B为CH2=C(CH3)2,结合A的核磁共振氢谱有2种不同化学环境的氢,所以A为(CH3)3COH,A发生消去反应得B,C氧化得D,D氧化得E, ,
, ;
;  ,
, ;
; +3NaOH
+3NaOH| 水 |
 +2NaCl+2H2O,
+2NaCl+2H2O, +3NaOH
+3NaOH| 水 |
 +2NaCl+2H2O;
+2NaCl+2H2O; )的同分异构体中,能同时满足如下条件①苯环上只有两个取代基,②分子中不含甲基;③能与FeCl3溶液发生显色反应,说明不酚羟基,④1mol该有机物最多能与3molNaOH反应,说明除有一个酚羟基外还有一个酚酯的结构,符合这样条件的结构为苯环上连有两个基团CH2=CH2CHCOO-、-OH或
)的同分异构体中,能同时满足如下条件①苯环上只有两个取代基,②分子中不含甲基;③能与FeCl3溶液发生显色反应,说明不酚羟基,④1mol该有机物最多能与3molNaOH反应,说明除有一个酚羟基外还有一个酚酯的结构,符合这样条件的结构为苯环上连有两个基团CH2=CH2CHCOO-、-OH或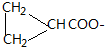 、-OH,它们互为邻、间、对的位置关系,所以共有6 种(不考虑立体异构),上述同分异构体中,核磁共振氢谱有7个吸收峰的有机物的结构简式为
、-OH,它们互为邻、间、对的位置关系,所以共有6 种(不考虑立体异构),上述同分异构体中,核磁共振氢谱有7个吸收峰的有机物的结构简式为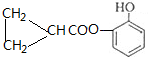 ,
,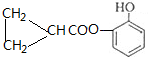 .
.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
A、 表示的粒子不会对水的电离平衡产生影响 表示的粒子不会对水的电离平衡产生影响 |
B、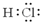 表示的物质加入水中,促进水的电离,c(H+)增大 表示的物质加入水中,促进水的电离,c(H+)增大 |
C、25℃时,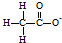 表示的微粒加入水中,促进水的电离,Kw不变 表示的微粒加入水中,促进水的电离,Kw不变 |
| D、水的电离程度只与温度有关,温度越高,电离程度越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3+H2SO4═Na2SO4+CO2↑+H2O |
| B、CaCO3+2HCl═CaCl2+CO2↑+H2O |
| C、KHCO3+HCl═KCl+CO2↑+H2O |
| D、BaCO3+2HNO3═Ba(NO3 )2+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
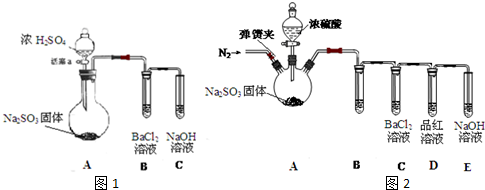
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
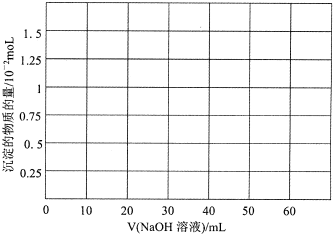
| 盐酸 |
| Ⅰ |
| 蒸馏 |
| Ⅱ |
| 水 |
| Ⅲ |
| Zn |
| Ⅳ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸).
H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com