
(14分)下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系。请回答下列问题:

(1)Y在元素周期表中位于第____周期、第 族;P的基态原子核外电子排布式为________。
(2)Y、P、R第一电离能大小的顺序为 (用化学符号表示,下同),X、R、W的气态氢化物水溶液酸性大小顺序为 。
(3)X、Z的单质按物质的量比1:2反应生成的化合物中化学键类型有 ;计算2mol该化合物与标准状况下33. 6LCO2和l0mol水蒸气混合物充分反应后转移电子的物质的量是 。
(4)Q单质与Z的最高价氧化物对应水化物的浓溶液反应,化学方程式为 。
(5)已知:反应I CaSO4( s)+CO(g) CaO(s)+SO2(g)+CO2(g) △H=+218.4kJ/mol
CaO(s)+SO2(g)+CO2(g) △H=+218.4kJ/mol
反应Ⅱ CaSO4(s)+4CO(g) CaS(s)+4CO2(g) △H=-175.6kJ/mol
CaS(s)+4CO2(g) △H=-175.6kJ/mol
假设某温度下,反应I的速率(v1)大于反应II的速率(v2),则下列反应过程能量变化示意图正确的是

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源:2014-2015学年福建省高三4月质量检查理综化学试卷(解析版) 题型:选择题
下列溶液中,一定呈中性的是
A.由非电解质溶于水得到的溶液
B.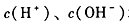 均为
均为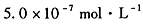 的溶液
的溶液
C.等物质的量的强酸与强碱反应得到的溶液
D.将pH =9的烧碱溶液稀释100倍所得到的溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南周口市高三3月教学质量监测理综化学试卷(解析版) 题型:选择题
下列有关说法错误的是
A.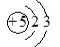 既可以表示10B的原子结构,也可以表示11B的原子结构
既可以表示10B的原子结构,也可以表示11B的原子结构
B.H++OH-=H2O既可以表示NaOH与盐酸反应,也可以表示Ba(OH)2与硫酸反应
C.CH4分子的空间结构与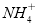 的相同
的相同
D.C2H4O2既可以表示乙酸的分子式,也可以表示甲酸甲酯的分子式
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省淮北市高三第二次模拟考试理综化学试卷(解析版) 题型:推断题
(15分)玉米芯是用玉米棒破碎筛选而成,主要成分是聚戊糖,在酸性条件下水解为戊糖(A,分子式C5H10O4),下图是用戊糖为原料合成乙酰丙酸正丁酯E的工艺如下:
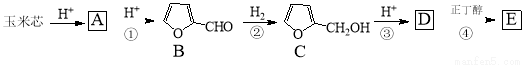
已知:戊糖A可以在酸性条件下脱水、成环生成糠醛B
(1)戊糖A分子中的官能团名称是___________。CH3CO-为乙酰基,写出E的结构简式_________。
(2)指出反应类型:②______反应,④______反应。
(3)糠醛可以与丙酮合成糠醛树脂 。写出反应的化学方程式_______________(不必注明反应条件)。
。写出反应的化学方程式_______________(不必注明反应条件)。
(4)写出满足下列条件C的同分异构体的结构简式_______(任写一种)。
①1mol该同分异构体可与2mol氢气反应;
②核磁共振氢谱只有2个吸收峰
(5)下列叙述正确的是______。
a.A能发生银镜反应
b.B的分子式为C5H4O2
c.1molC完全燃烧消耗5.5 mol O2
d.D能与氢气发生加成反应
e.B中π键数目为2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省淮北市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列有关粒子组的评价及相关离子方程式均正确的是
选项 | 粒子组 | 评价及离子方程式 |
A | K+、Al3+、 SO42-、NO3- | 能大量共存于同一溶液中 |
B | H+、CH3CHO、SO42-、MnO4- | 能大量共存于同一溶液中 |
C | NH4+、Fe3+、SCN-、Cl- | 不能大量共存,Fe3+ +3SCN- = Fe(SCN)3↓ |
D | Na+、K+、HCO3-、OH- | 不能大量共存,HCO3- + OH- = H2O + CO2↑ |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省黄山市高三毕业班第二次质量检测理综化学试卷(解析版) 题型:选择题
关于下列各装置图(略去部分夹持仪器)的叙述中,正确的是
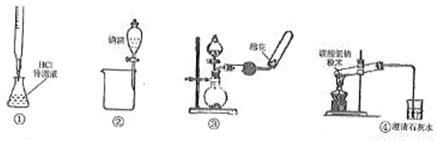
A.利用装置①进行盐酸待测液浓度的测定
B.利用装置②分离碘酒中碘和酒精
C.利用装置③制备收集干燥氨气
D.利用装置④加热分解碳酸氢钠
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省台州市高一下学期第一次月考化学试卷(解析版) 题型:填空题
(6分)完成下列化学反应方程式并注明反应类型。
1、乙烯与水一定条件下反应
2、甲烷与氯气光照条件下反应(只写第一步)
3、苯与浓硝酸,浓硫酸一定条件下反应
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省台州市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列各表中的数字代表的是元素的原子序数,表中数字所表示的元素与它们在周期表中的相对位置相符的是
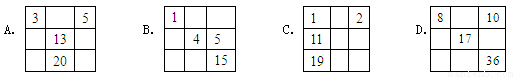
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北武汉市高三毕业生四月调研测试理综化学试卷(解析版) 题型:填空题
(15分)合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:CO(NH2)2 (s) + H2O(l) == 2 NH3(g)+CO2(g) △H = +133.6 kJ/mol。该反应的化学平衡常数的表达式K= 。关于该反应的下列说法正确的是 (填序号)。
2 NH3(g)+CO2(g) △H = +133.6 kJ/mol。该反应的化学平衡常数的表达式K= 。关于该反应的下列说法正确的是 (填序号)。
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
②尿素在一定条件下可将氮的氧化物还原为氮气。

结合①中信息,尿素还原NO(g)的热化学方程式是 。
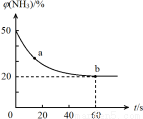
②密闭容器中以等物质的量的NH3和CO2为原料,在120 ℃、催化剂作用下反应生成尿素:CO2(g) +2NH3(g) ==CO (NH2)2 (s) +H2O(g),混合气体中NH3的物质的量百分含量[(NH3)]随时间变化关系如图所示。则a点的正反应速率V(正)(CO2) b点的逆反应速率V(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是 。
==CO (NH2)2 (s) +H2O(g),混合气体中NH3的物质的量百分含量[(NH3)]随时间变化关系如图所示。则a点的正反应速率V(正)(CO2) b点的逆反应速率V(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是 。
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2 g NO2和Na2CO3溶液完全反应时转移电子0.1 mol,此反应的离子方程式是 ;恰好反应后,使溶液中的CO2完全逸出,所得溶液呈弱碱性,则溶液中离子浓度大小关系是c(Na+)>______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com