
绿色化学提倡化工生产应提高原子利用率。原子利用率表示目标产物的质量与生成物总质量之比。在下列制备环氧乙烷( 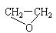 )的反应中,原子利用率最高的是( ).
)的反应中,原子利用率最高的是( ).
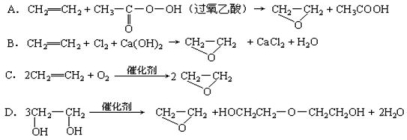
科目:高中化学 来源:2013-2014甘肃兰州一中高一下学期期末考试化学试卷(解析版) 题型:选择题
下列物质中,不能使酸性KMnO4溶液褪色的物质是
① ②乙烯 ③CH3COOH;④CH3CH2OH ⑤CH2=CH—COOH ⑥
②乙烯 ③CH3COOH;④CH3CH2OH ⑤CH2=CH—COOH ⑥
A.①⑥B.①③④⑥C.①④D.①③⑥
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高二下学期期末考试化学试卷(解析版) 题型:选择题
在2009年10月1日,新的饮用矿泉水强制性国家标准《饮用天然矿泉水》正式实施,其中“溴酸盐(BrO3-)”这一潜在致癌物质被做了严格限制。有关专家解释,矿泉水在开采过程中会含有少量溴化物(Br-),在后续的生产过程中经臭氧(O3)处理逐渐转化成溴酸盐。下列有关该转化过程的认识正确的是( )
A.该过程中溴化物(Br-)得到电子
B.该过程中臭氧(O3)是氧化剂,溴酸盐(BrO3-)是还原剂
C.该过程中溴元素被还原,氧元素被氧化
D.该过程中溴元素发生氧化反应,氧元素发生还原反应
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高二下学期期末考试化学试卷(解析版) 题型:选择题
PM2. 5是指大气中直径小于或等于2.5微米的颗粒物,严重危害人体健康,也称为可入肺颗粒物。近年来我国PM2.5污染问题日益凸显。2013年长沙市开展PM2.5和臭氧监测,每天都公布空气质量级别。下面所列各项,在空气质量日报中完全正确的是( )
①可吸入颗粒物 ②总悬浮颗粒物 ③氢氧化物 ④二氧化碳 ⑤二氧化硫
⑥二氧化氮 ⑦一氧化碳 ⑧一氧化氮 ⑨氮气 ⑩臭氧
A.①③⑤⑦⑨ B.②③⑤⑥⑦ C.②④⑥⑦⑩ D.①⑤⑥⑦⑩
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高一下学期期末考试化学试卷(解析版) 题型:选择题
X、Y为短周期元素,X原子中K、L、M各电子层的电子数之比为1:4:1,Y原子比X原子少3个电子,下列叙述正确的是
A.X、Y形成化合物表示为X2Y
B.X、Y形成的化合物中所含离子都是10电子微粒
D. X原子半径小于Y的原子半径
C.Y位于周期表中第ⅦA族,其最高正化合价为+7
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高一下学期期末考试化学试卷(解析版) 题型:选择题
下列反应既属于氧化还原反应,又是吸热反应的是( )
A.铝与稀盐酸的反应 B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应 D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高一下学期期末考试化学试卷(解析版) 题型:选择题
环境污染已成为人类社会面临的重大威胁,各种污染数不胜数。下列名词与环境污染无关的是
①温室效应 ②赤潮 ③酸雨 ④光化学污染 ⑤臭氧层空洞 ⑥水俣病 ⑦潮汐 ⑧大脖子病
A.①②③ B.⑦⑧ C.①⑤⑥ D.②⑤⑦
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省益阳市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列操作不能达成实验目的的是( )
A.溴乙烷与氢氧化钠溶液共煮后,加硝酸后再加入硝酸银溶液检验溴
B.用电石和饱和食盐水制取乙炔
C.用苯、2 mol/L的硝酸和3 mol/L的硫酸制硝基苯
D.用稀硝酸洗涤做过银镜反应的试管
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省怀化市高三第三次模拟考试理综化学试卷(解析版) 题型:填空题
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
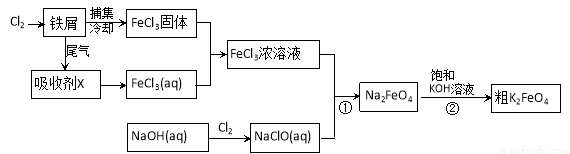
请回答下列问题:
(1)氯化铁有多种用途:
①氯化铁做净水剂。请用离子方程式表示其原理____________ __________;
②工业上常用FeCl3溶液腐蚀铜印刷线路板。这是利用了FeCl3较强的__________性。
(2)吸收剂X的化学式为 。为检验吸收剂是否已完全转化为FeCl3溶液,有人设计用酸性高锰酸钾溶液,但很快被否定,理由是(用离子方程式表示) 。正确的检验方法是:取少量待测液,加入 (写化学式)溶液,若无深蓝色沉淀产生,则证明转化完全。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4  K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
(5)将粗K2FeO4产品经重结晶、过滤、 、 ,即得较纯净的K2FeO4。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com