
| A. | 乙二醇用于汽车防冻液 | |
| B. | 麦芽糖在水解前后均能发生银镜反应 | |
| C. | 1-氯丙烷和2-氯丙烷发生消去反应的产物不同 | |
| D. | H2N-CH2-COOH的缩聚产物中含  结构 结构 |
分析 A.乙二醇水溶液的熔点较低;
B.麦芽糖及其水解产物葡萄糖有醛基,能发生银镜反应;
C.卤代烃在氢氧化钠的水溶液中发生取代反应;卤代烃在氢氧化钠的醇溶液中发生消去反应,是与卤素原子相邻的碳上的一个氢同时脱去,形成不饱和键;
D.氨基酸形成肽键原理为羧基提供-OH,氨基提供-H.
解答 解:A.乙二醇水溶液的熔点较低,乙二醇型防冻液采用乙二醇与软水按不同比例混合而成,故A正确;
B.麦芽糖及其水解产物葡萄糖有醛基,能发生银镜反应,故B正确;
C.1-氯丙烷发生消去反应的方程式为CH3CH2CH2Cl+NaOH$→_{△}^{醇}$CH3CH=CH2↑+NaCl+H2O,2-氯丙烷发生消去反应的方程式为CH3CHClCH3+NaOH$→_{△}^{醇}$CH3CH=CH2↑+NaCl+H2O,故C错误;
D.氨基酸形成肽键原理为羧基提供-OH,氨基提供-H,缩聚形成 ,故D正确.
,故D正确.
故选C.
点评 本题考查有机物的结构和性质,题目难度中等,解答该题时需理解消去反应,掌握断键的位置.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
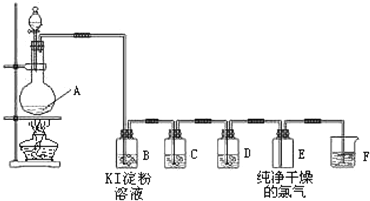
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
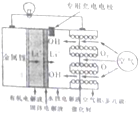 如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )
如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )| A. | 放电时,锂离子(Li+)穿过固体电解质移到负极的水性电解液中 | |
| B. | 充电时,阳极的电极反应式为:4OH--4e-=O2+2H2O | |
| C. | 熔融的氢氧化锂用惰性电极电解再生时,在阴极可得到金属锂,放电时负极的电极反应式为:Li-e-=Li+ | |
| D. | 充电时,锂极与外电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
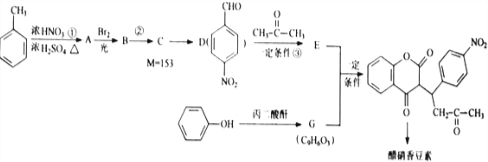
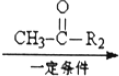 R1-CH=
R1-CH=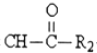 +H2O
+H2O .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验装置 | 实验目的 |
| A | 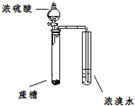 | 证明浓硫酸具有脱水性、氧化性 |
| B | 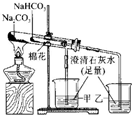 | 比较碳酸钠与碳酸氢钠固体的热稳定性 |
C | 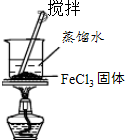 | 制取少量的Fe(OH)3胶体 |
| D | 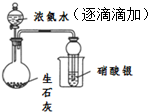 | 证明浓氨水与生石灰作用可制备得到氨气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2、I2、Hg | B. | CO2、KCl、SiO2 | ||
| C. | HF、HCl、HBr | D. | CH4、C2H5OH、C4H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量H2 C2O4固体,促进水电离,溶液中c(H+)增大 | |
| B. | 加入NaOH溶液至恰好完全反应,则溶液中:c(Na+)>c(C2O42-)>c(HC2O4-)>c(H+) | |
| C. | 加入氨水至中性,则溶液中:c(NH4+)+c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | 加入0.01 mol Na2C2O4固体,则溶液中:3c(Na+)=2[c(H2C2O4)+c(HC2O4- )+c(C2O42-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
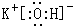 .
.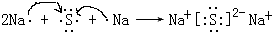 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.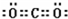 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
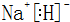 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com