

���� �ٿ��淴Ӧ����ƽ��ʱ��ͬ�����ʵ�����������ȣ�����ֵ�Ũ�ȡ��������ֲ��䣬�ɴ�����������һЩ�����䣬�ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����仯˵������ƽ�⣻
�ڼ�����t���Ӻ�Ӧ���ﵽƽ�⣬���ɵ�NH3��Ϊ0.4mol����
N2��g��+3H2��g��?2NH3��g��
��ʼ����mol����0.4 1.2 0
�仯����mol����0.2 0.6 0.4
ƽ������mol����0.2 0.6 0.4
�ٸ���K=$\frac{{c}^{2}��N{H}_{3}��}{c��{N}_{2}����{c}^{3}��{H}_{2}��}$����ƽ�ⳣ�������º�����ѹǿ֮�ȵ����������ʵ���֮�ȣ�
��� �⣺��A���淴Ӧ�����������ʵ�����С�����º�����������ѹǿ��С����ѹǿ����ʱ��ı䣬˵������ƽ��״̬����A��ȷ��
B������������������䣬�����ݻ����䣬���������ܶ�Ϊ��ֵ����B����
C������ƽ��ʱ�����Ũ�ȱ��ֲ��䣬c��N2������ʱ��ı䣬˵���ﻯѧƽ��״̬����C��ȷ��
D����λʱ��������2molNH3��ͬʱ����1molN2������ʾ����Ӧ���ʣ���Ӧʼ�հ��ñ�����ϵ���У���D����
E����λʱ���ڶ���3molH-H����ͬʱ����6molN-H����������6molN-H��������3molH-H������������������������������ȣ���Ӧ����ƽ�⣬��E��ȷ��
��ѡ��ACE��
�ڼ�����t���Ӻ�Ӧ���ﵽƽ�⣬���ɵ�NH3��Ϊ0.4mol����
N2��g��+3H2��g��?2NH3��g��
��ʼ����mol����0.4 1.2 0
�仯����mol����0.2 0.6 0.4
ƽ������mol����0.2 0.6 0.4
��ƽ�ⳣ��K=$\frac{{c}^{2}��N{H}_{3}��}{c��{N}_{2}����{c}^{3}��{H}_{2}��}$=$\frac{��\frac{0.4}{2}��^{2}}{\frac{0.2}{2}����\frac{0.6}{2}��^{3}}$=$\frac{400}{27}$��
���º�����ѹǿ֮�ȵ����������ʵ���֮�ȣ���ƽ��ʱ����ѹǿPƽ=$\frac{1.2mol}{1.6mol}$P0=$\frac{3}{4}$P0��
�ʴ�Ϊ��$\frac{400}{27}$��$\frac{3}{4}$P0��
���� ���⿼�黯ѧƽ����㡢ƽ��״̬�жϣ�ע������ʽ�ڻ�ѧƽ�������Ӧ�ã�ע���ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����ٱ仯˵������ƽ�⣮


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
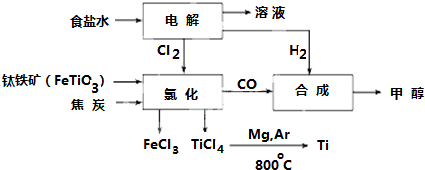
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | H2��I2��HI�����еĻ�ѧ�����ǷǼ��Թ��ۼ� | |
| B�� | �Ͽ�2 mol HI�����еĻ�ѧ����������ԼΪ��c+b+a��kJ | |
| C�� | ��ͬ�����£�1molH2��g����1mol I2��g��������С��2mol HI��g���������� | |
| D�� | ���ܱ������м���2mol H2��g����2mol I2��g������ַ�Ӧ��ų�������Ϊ2akJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �������ȣ�ClO2��Ϊһ�ֻ���ɫ���壬�ǹ����Ϲ��ϵĸ�Ч�����ס����١���ȫ��ɱ����������
�������ȣ�ClO2��Ϊһ�ֻ���ɫ���壬�ǹ����Ϲ��ϵĸ�Ч�����ס����١���ȫ��ɱ�����������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��1���ͣ�6�� | B�� | ��3���ͣ�4�� | C�� | ��2���ͣ�4�� | D�� | ��2���ͣ�5�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ƽ���ƶ���Kֵһ���仯 | B�� | Kֵ�仯��ƽ��һ���ƶ� | ||
| C�� | ƽ���ƶ���Kֵ���ܲ��� | D�� | Kֵ���䣬ƽ������ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Ԫ�� | �����Ϣ |
| M | ����������Ӧ��ˮ�����ܰ�1��1�������������ȵ����������� |
| Q | ��������������������������֮��Ϊ4���ǽ�������ͬ����Ԫ������ǿ |
| X | �䵥��Ϊ����ɫ���� |
| Y | ij�ֺ���ԭ�ӵ�������Ϊ56��������Ϊ30 |
| Z | XԪ�صĵ�����ZԪ�صĵ�����ȼ�գ���������������ɫ���� |

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com