
| A. | 2mol | B. | 4mol | C. | 6mol | D. | 8mol |
分析 根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入 Cu(OH)2后溶液与电解前相同,Cu(OH)2从组成上可看成CuO•H2O,所以实际上相当于加入的物质是氧化铜和水.
解答 解:加入1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,Cu(OH)2从组成上可看成CuO•H2O,根据“析出什么加入什么”的原则知,析出的物质是氧化铜和水,则阴极上析出氢气和铜,生成1mol铜转移电子=1mol×2mol=2mol,根据原子守恒知,生成1mol水需要1mol氢气,生成1mol氢气转移电子=1mol×2mol=2mol,所以电解过程中共转移电子数为4mol,
故选B.
点评 本题考查了电解原理,明确阴极上析出的物质是解本题关键,根据生成物与转移电子之间的关系式来解答即可,难度中等.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 250mL2mol•L-1的氨水中含有NH3•H2O的分子数为0.5NA | |
| B. | 0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.2 NA | |
| C. | 1 L 0.5 mol•L-1 Na2CO3溶液中含有的CO32-数为0.5NA | |
| D. | t℃时,pH=6 的纯水中含有OH-的个数为10-6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
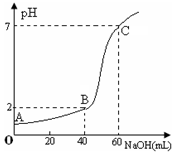 常温下,取20mL某浓度的盐酸作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述不正确的是( )
常温下,取20mL某浓度的盐酸作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述不正确的是( )| A. | 所用盐酸的浓度是0.09mol•L─1,NaOH溶液浓度为0.03mol•L─1 | |
| B. | 在B点,溶液中离子浓度关系为:c(Cl─)>c(Na+)>c(OH-)>c(H+) | |
| C. | A、B、C三点水的电离程度大小依次为:C>B>A | |
| D. | 滴定前,锥形瓶用待测液润洗,导致盐酸浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2是极性键构成的极性分子 | |
| B. | SO2与CO2为等电子体 | |
| C. | 金属晶体的六方最密堆积和面心立方最密堆积的方式空间利用率最高 | |
| D. | NaCl和CsCl的化学式相同,所以晶胞特点也是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PM2.5含有的铅、铬、镉、钒、砷等对人体有害的元素均是金属元素 | |
| B. | 绿色化学的核心是利用化学原理减少和消除工业生产对环境的污染 | |
| C. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| D. | 二氧化硫的大量排放是造成光化学烟雾的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) | |
| B. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则C1=l0C2 | |
| C. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| D. | NaHCO3溶液中有:HCO3-+H2O?CO32-+H3O+加水稀释后,H+浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com