
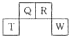
 短周期元素Q、P、T、W在元素周期表中的位置如图所示,其中Q的原子序数为其周期序数的3倍.下列叙述错误的是( )
短周期元素Q、P、T、W在元素周期表中的位置如图所示,其中Q的原子序数为其周期序数的3倍.下列叙述错误的是( )| A、QW2是含极性键的非极性分子 | B、四种元素的最高价氧化物能与强碱反应 | C、RHn在同族元素的气态氢化物中沸点最低 | D、R、W常见单质的晶体类型相同 |


 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
| D的单质 |
| D的单质 |
| H2O |




| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省执信中学高一下学期期末考试化学试卷(带解析) 题型:填空题
(12分)短周期元素Q、R、T、P、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为 ,用化学方程式表示工业上冶炼该单质的反应原理 。
(2)元素的非金属性:Q P(填“>”或“<”),可以证明该结论的实验是(用化学方程式表示) 。
(3)R的氢化物的结构式为 ,实验室检验该氢化物的方法是
_______________________________________________________________。
(4) W在周期表的位置为_________。W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,该气体的化学式为 。利用该气体的
性,在海水提溴的过程中用该气体的水溶液吸收用空气吹出的溴蒸气。
查看答案和解析>>
科目:高中化学 来源:2014届广东省高一下学期期末考试化学试卷(解析版) 题型:推断题
(12分)短周期元素Q、R、T、P、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:

(1)T的原子结构示意图为 ,用化学方程式表示工业上冶炼该单质的反应原理 。
(2)元素的非金属性:Q P(填“>”或“<”),可以证明该结论的实验是(用化学方程式表示) 。
(3)R的氢化物的结构式为 ,实验室检验该氢化物的方法是
_______________________________________________________________。
(4) W在周期表的位置为_________。W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,该气体的化学式为 。利用该气体的
性,在海水提溴的过程中用该气体的水溶液吸收用空气吹出的溴蒸气。
查看答案和解析>>
科目:高中化学 来源:2010年宁波市八校高一下学期期末联考化学试题 题型:填空题
现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构。已知:
①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:
④E和D是同主族元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y。
请回答下列问题:
(1)B元素的名称是 ▲ ;(2)E元素的原子结构示意图是 ▲ 。
(3)请将C的元素符号填在如图所示的元素周期表的适当位置上。
|
(4)G的电子式为 ▲ 。
(5)化合物X所含化学键类型有 ▲ 。
(6)①A的氧化物与NaOH溶液反应的离子方程式为 ▲ 。
②M的稀溶液与铜反应的化学方程式为 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com