
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
下列有关说法正确的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2 c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1
C.根据上表, 水解方程式ClOˉ+ H2O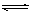 HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
C
【解析】
试题分析:A、根据表中数据及盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大,相同浓度时溶液的碱性越强,pH越大,注意Na2CO3所对应的酸为HCO3-,NaHCO3所对应的酸为H2CO3,酸性:HCO3-<HClO <H2CO3<HF,在相同温度下,同浓度的三种酸溶液的导电能力顺序:HClO<H2CO3<HF,错误;B、0.1 mol·L-1Na2CO3溶液中,c(Na+) = 0.2 mol·L-1,将CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液中性,此时溶液为碳酸和NaHCO3 的混合液,溶液的体称没有变,溶液中的钠离子的浓度仍然为:c(Na+) =0.2 mol·L-1,根据电荷守恒有:c(Na+) + c(H+) = c (HCO3ˉ) + 2 c (CO32-) + c(OHˉ),由于溶液呈中性:c(H+) = c(OHˉ),则c(Na+) = 2 c (CO32ˉ)+ c (HCO3ˉ)= 0.2mol·L-1,错误;C、根据水解方程式:ClOˉ+ H2O HClO + OHˉ,水解的平衡常数表为;
HClO + OHˉ,水解的平衡常数表为; ,从上表可知常温下浓度为0.1 mol·L-1 NaClO溶液的pH=9.7,则c(OHˉ) = c(HClO)=10-4.3,所以K≈10ˉ7.6,正确;D、向NaClO 溶液中通HF气体至恰好完全反应时,此时溶液为等物质的量浓度的NaF和HClO的混合液,由于弱电解质的电离是微弱的,故溶液中c(HClO)>c(H+)、c(OHˉ),错误。
,从上表可知常温下浓度为0.1 mol·L-1 NaClO溶液的pH=9.7,则c(OHˉ) = c(HClO)=10-4.3,所以K≈10ˉ7.6,正确;D、向NaClO 溶液中通HF气体至恰好完全反应时,此时溶液为等物质的量浓度的NaF和HClO的混合液,由于弱电解质的电离是微弱的,故溶液中c(HClO)>c(H+)、c(OHˉ),错误。
考点:考查电解质溶液中粒子浓度大小比较。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年陕西省高三上学期12月月考理综化学试卷(A)(解析版) 题型:选择题
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。下列说法不正确的是
A.离子半径: Z>W >Y B.非金属性最强的元素为W
C.Y的最高价氧化物对应的水化物为两性 D.XW2是离子化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三1月月考理综化学试卷(解析版) 题型:选择题
下列说法正确的是:
A.新制氯水中加入固体NaOH, 则:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.25℃时,稀释0.5 mol·L-1的NH4Cl溶液,水解平衡右移,溶液的PH减小
C.常温下,pH=11的碱MOH溶液与pH=3的盐酸等体积混合后,溶液可能呈中性或酸性
D.测定相同条件下Na2CO3溶液和Na2SO4溶液的pH,判断碳与硫的非金属性强弱
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:填空题
(18分)铵盐在工农业生产中有着重要的用途,请根据要求完成下列各题。
Ⅰ.某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液。
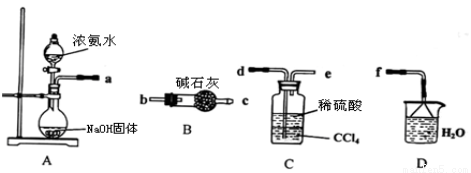
(1)仪器连接的顺序(用接口序号字母表示)是:a
(2)试从电离平衡角度分析该实验装置A中能产生氨气的原因: 。
(3)将装置C中两种液体分离开的操作名称是 。
Ⅱ.为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图:
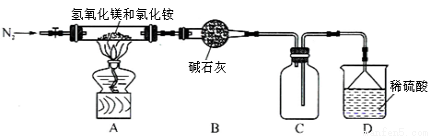
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为 。
(2)反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,二是 。
(3)由MgCl2溶液得到MgCl2·6H2O晶体,操作为 、 、
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是: 。
②由MgCl2·6H2O加热制备无水MgCl2的操作在 氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.酸性氧化物和碱性氧化物都是电解质
B.将NaOH溶液逐滴加入FeCl3溶液可制备Fe(OH)3胶体
C.电化学腐蚀是造成金属腐蚀的主要原因
D.离子键一定只存在于离子化合物中,共价键一定只存在于共价化合物中
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:选择题
在下列给定条件的溶液中,一定能大量共存的离子组是
A.加水稀释C(OH?)/C(H+)增大的溶液:K+、Na+、SO42-、[Al(OH)4]-
B.常温下Kw/c(H+)=0.1 mol/L的溶液:K+、Na+、SiO32-、NO3-
C.铁片加入产生气泡的溶液:Na+、NH4+、I-、NO3-
D.NaHCO3溶液:K+、Na+、SO42-、Al3+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
一定温度下,1molX和n mol Y在容积为2L的密闭容器中发生如下反应:
X(g)+Y(g)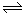 Z(g)+M(s),5min后达到平衡,此时生成a mol Z。下列说法正确的是
Z(g)+M(s),5min后达到平衡,此时生成a mol Z。下列说法正确的是
A.向平衡后的体系中加入1mol M,平衡向逆反应方向移动
B.用X表示此反应的反应速率是(0.1—0.1a)mol·(L·min)—1
C.向上述平衡体系中再充入1molX,v(正)增大,v(逆)减小,平衡正向移动
D.当混合气体的质量不再发生变化时,说明反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
| 活性炭 |
| 400℃ |
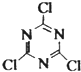 下列有关说法正确的是( )
下列有关说法正确的是( )| A、三聚氯氰中C1的化合价是+1 |
| B、该反应中NaCN被还原 |
| C、三聚氯氰分子中既含σ键又含π健 |
| D、36.9 g三聚氯氰中含有1.204×1023个原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com