
【题目】下列反应不属于氧化还原反应的是
A. Zn+2HCl===ZnCl2+H2↑
B. Ca(ClO)2+2HCl===CaCl2+2HClO
C. Pb3O4+8HCl(浓)===3PbCl2+Cl2↑+4H2O
D. 3Cl2+6KOH(浓)![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
【答案】B
【解析】
反应过程中不存在电子转移,说明不是氧化还原反应,据此判断。
A. 反应Zn+2HCl=ZnCl2+H2↑中锌失去电子,氢元素得到电子,是氧化还原反应,存在电子转移,A不符合;
B. 反应Ca(ClO)2+2HCl=CaCl2+2HClO中元素的化合价均没有发生变化,不是氧化还原反应,不存在电子转移,B符合;
C. 反应Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O中氯元素失去电子,铅元素得到电子,是氧化还原反应,存在电子转移,C不符合;
D. 反应3Cl2+6KOH(浓)![]() 5KCl+KClO3+3H2O中氯元素化合价部分升高部分降低,属于氧化还原反应,存在电子转移,D不符合。
5KCl+KClO3+3H2O中氯元素化合价部分升高部分降低,属于氧化还原反应,存在电子转移,D不符合。
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1)含有6.02×1023个H的H2O,其物质的量是_______;1 mol Na2SO4溶于水能电离出______个Na+。
(2)______mol H2O中含有的氧原子数与1.5 mol CO2中含有的氧原子数相等。
(3)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为________。
(4)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体中,NH3的体积分数为__________,该混合气体对氢气的相对密度为________。
(5)已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,则C的摩尔质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CO32-、Cl-、OH-、SO42- |
已知:
①常温下A、C溶液pH均大于7,B溶液pH小于7,D溶液pH等于7;
②C溶液和D溶液混合只产生白色沉淀;
③B溶液和C溶液混合共热时只产生刺激性气味的气体;
④A溶液和D溶液混合时无明显现象。
请回答:
(1)D的化学式_______________________。
(2)实验③反应的离子方程式_______________________。
(3)从B、C、D中选取物质,设计实验方案确定A的组成_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组用如图所示过程除去硫酸铝中含有的Mg2+、K+杂质离子并尽可能减少硫酸铝的损失。
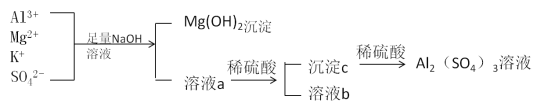
请回答下列问题:
(1)混合物中加入足量氢氧化钠溶液时,反应的离子方程式是________________、________________________________。
(2)能否用氨水代替氢氧化钠溶液____________,其原因是____________________________。
(3)溶液a中存在的离子有________________________,在溶液a中加入稀硫酸时需控制硫酸的量,其原因是__________________________________________,改进方法是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用含硫废水生产Na2S2O3·5H2O,实验室用如下装置(略去部分夹持仪器)模拟生成过程。
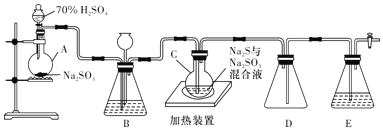
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若____________,则整个装置气密性良好,装理D的作用是___________。装置E中为_________________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则理论上烧瓶C中Na2S和Na2SO3的物质的量之比为____________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择__________(填字母代号)。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是___________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是____________________________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器有_____________。
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O35H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:__________________________________。(已知Na2S2O35H2O遇酸易分解:S2O32- + 2H+ =S↓+ SO2↑+ H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. ![]() C表示质子数为6、中子数为8的核素
C表示质子数为6、中子数为8的核素
B. 甲醇(CH3OH)和甘油(CH2OHCHOHCH2OH)互为同系物
C. C5H12的同分异构体有3种,其沸点各不相同
D. CH3CH2CH2CH(CH3)2的名称是2甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 甲烷分子的比例模型为![]() ,其二氯取代物有2种结构
,其二氯取代物有2种结构
B. 苯和乙烯都能使溴水褪色,其褪色原理相同
C. 相同质量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的物质的量相同
D. 在一定条件下,苯与氯气生成氯苯的反应类型是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还取性:SO32->I-。向含有a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是
A. 当a≥b时,发生的离子反应为SO32-+Cl2+H2O=SO42-+2H++2Cl-
B. 当 5a=4b时,发生的离子反应为 4SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl-
C. 当 a≤b≤![]() 时,反应中转移电子的物质的量n(e-)为 a mol≤n(e-)≤3a mol
时,反应中转移电子的物质的量n(e-)为 a mol≤n(e-)≤3a mol
D. 当a<b<![]() 时,溶液中SO42-、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b
时,溶液中SO42-、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com