


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
| A、胶体与其他分散系的本质区别是粒子直径的大小 |
| B、Fe(OH)3胶体能产生丁达尔效应 |
| C、明矾净水是利用胶体的吸附性 |
| D、雾、豆浆、淀粉溶液属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,17.6g丙烷中所含的极性共价键为4NA |
| B、常温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| C、常温下,将5.6g铁投入到足量浓硝酸中,反应转移的电子数目为0.3NA |
| D、12 g金刚石中含有的共价键数为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
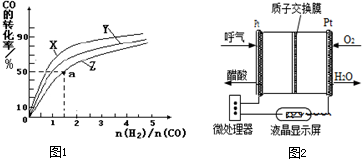
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
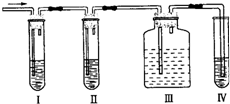 某混合气体可能是乙烯和二氧化硫的混合气,有人设计下列实验图以确认上述混合气体中有CH2=CH2和SO2.Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中盛放的试剂依次是:品红溶液、NaOH溶液、品红溶液、酸性KMnO4溶液.回答下列问题:
某混合气体可能是乙烯和二氧化硫的混合气,有人设计下列实验图以确认上述混合气体中有CH2=CH2和SO2.Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中盛放的试剂依次是:品红溶液、NaOH溶液、品红溶液、酸性KMnO4溶液.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com