
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
| A. | 偏高 | B. | 偏低 | C. | 不变 | D. | 无法判断 |
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 80g | B. | 160g | C. | 98g | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原铁和铝的物质的量相等 | |
| B. | 原盐酸的浓度为2mol•L-1 | |
| C. | 铁加入盐酸中的离子方程式为2Fe+6H+=2Fe3++3H2↑ | |
| D. | 盐酸与氢氧化钠溶液的物质的量浓度之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,N2将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| D. | 达到化学平衡时,N2和H2的转化率相同且c(N2):c(H2)=1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 元素 | o | p | |
| 电离能kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
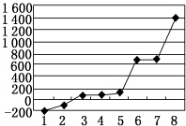
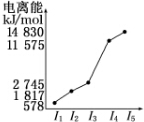
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com