
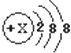
| A. | 第四周期IA | B. | 第三周期0族 | C. | 第二周期VIIA | D. | 第三周期VIIA族 |
分析 原子在变为阴离子时,质子数、中子数均不变,电子数增多,但电子层数不变,据此分析.
解答 解:由于原子在变为阴离子时,质子数、中子数均不变,电子数增多,但电子层数不变,且只有非金属元素即最外层电子数≥4的元素才能得电子变为阴离子,根据此元素的阴离子的结构示意图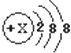 可知,此元素的原子的电子数小于18个,但多于14个,电子层数也为3层,故此元素位于第三周期,可能是第IVA族,或第VA族,或第VIA族,或第VIIA族,故选D.
可知,此元素的原子的电子数小于18个,但多于14个,电子层数也为3层,故此元素位于第三周期,可能是第IVA族,或第VA族,或第VIA族,或第VIIA族,故选D.
点评 本题考查了根据离子的结构示意图来分析元素在周期表中的位置,应注意的是只有非金属元素才能变为简单的阴离子,原子在变为阴离子时,质子数、中子数均不变,电子数增多,但电子层数不变.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
判断下列有关化学基本概念的依据正确的是
A.溶液与胶体:本质区别是能否发生丁达尔效应
B.纯净物与混合物:是否仅含有一种元素
C.氧化还原反应:元素化合价是否变化
D.电解质与非电解质:物质本身的导电性
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.01 mol/(L•s) | B. | v(NO)=0.08 mol/(L•s) | ||
| C. | v(H2O)=0.03 mol/(L•s) | D. | v(NH3)=0.002 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠、镁、铝的还原性依次减弱 | |
| B. | NaOH、Mg(OH)2、Al(OH)3碱性依次增强 | |
| C. | HCl、HBr、HI的稳定性依次增强 | |
| D. | HClO4、H2SO4、H3PO4的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸 | B. | 溴水 | C. | KSCN溶液 | D. | 酸性高锰酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
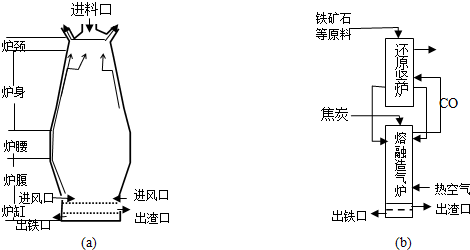
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③④ | C. | ①②③⑤ | D. | ①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com