
【题目】某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2·3H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2。设计的合成路线如下:
![]()
已知:Cu (NO3)2·3H2O ![]() Cu(NO3)2·Cu(OH)2
Cu(NO3)2·Cu(OH)2 ![]() CuO
CuO
SOCl2熔点 -105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。 请回答:
(1)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是_______。
(2)第④步中发生反应的化学方程式是_____________。
(3)第④步,某同学设计的实验装置示意图(夹持及控温装置省略,如图1有一处不合理,请提出改进方案并说明理由_______________。
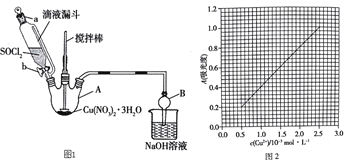
(4)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。
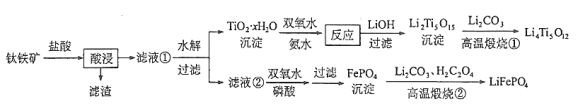
已知:4NH3·H2O + Cu2+ == Cu(NH3)42+ + 4H2O;Cu(NH3)42+ 对特定波长光的吸收程度(用吸光度A表示)与Cu2+ 在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与Cu2+ 标准溶液浓度关系如图2所示:准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100 mL,准确移取该溶液10.00mL,加过量NH3 ·H2O,再用蒸馏水定容至100 mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是_________(以质量分数表示)。
【答案】将溶液转移至蒸发皿中,控制温度加热至溶液表面形成一层晶膜 Cu(NO3)2 + 3H2O + 3SOCl2 = Cu(NO3)2 + 3SO2↑+ 6HCl↑ 在A, B间增加 一个干燥装置,防止B中水蒸气进入反应器A 92.5%
【解析】
(1)蒸发浓缩的目的是为了使晶体在溶液中析出得到含有结晶水的结晶水合物,根据具体操作要领分析回答;
(2)SOCl2遇水剧烈水解生成两种酸性气体,分别是SO2和HCl;
(3)根据实验目的,要制备少量无水Cu(NO3)2,应该防止B中的水分进入A中,据此分析改进理由;
(4)结合图2可以看出,溶液吸光度A=0.620时,实际测得Cu2+的浓度,根据n = ![]() 得到0.3150 g的无水Cu(NO3)的物质的量,再结合稀释规律与反应方程式计算出总的Cu2+的浓度,进而得出结论。
得到0.3150 g的无水Cu(NO3)的物质的量,再结合稀释规律与反应方程式计算出总的Cu2+的浓度,进而得出结论。
(1)蒸发浓缩的目的是为了使晶体在溶液中析出得到含有结晶水的结晶水合物,具体操作:将溶液转移至蒸发皿中,控制温度加热至溶液表面形成一层晶膜时停止加热,
故答案为:将溶液转移至蒸发皿中,控制温度加热至溶液表面形成一层晶膜;
(2)因为SOCl2遇水剧烈水解生成两种酸性气体,化学方程式为:SOCl2+H2O = SO2↑+2HCl↑,所以第④步中发生反应的化学方程式是:Cu(NO3)2 + 3H2O + 3SOCl2 = Cu(NO3)2 + 3SO2↑+ 6HCl↑,
故答案为:Cu(NO3)2 + 3H2O + 3SOCl2 = Cu(NO3)2 + 3SO2↑+ 6HCl↑;
(3)因为要制备无水Cu(NO3)2,所以应该防止B中的水分进入A中,应该在A、B之间增加干燥装置,防止B中水蒸气进入反应器A,
故答案为:在A、B间增加一个干燥装置,防止B中水蒸气进入反应器A;
(4)根据图2信息可知,当溶液的吸光度A=0.620时,对应的Cu2+的浓度为1.550![]() 10-3 mol/L,0.3150 g的无水Cu(NO3)的物质的量为
10-3 mol/L,0.3150 g的无水Cu(NO3)的物质的量为![]() = 1.6755
= 1.6755![]() 10-3 mol,配制成100 mL溶液时,再移取10.00 mL该溶液,则与过量NH3 ·H2O反应的Cu(NO3)的物质的量为1.6755
10-3 mol,配制成100 mL溶液时,再移取10.00 mL该溶液,则与过量NH3 ·H2O反应的Cu(NO3)的物质的量为1.6755![]() 10-4 mol,根据反应4NH3·H2O + Cu2+ == Cu(NH3)42+ + 4H2O可知,生成Cu(NH3)42+的物质的量也为1.6755
10-4 mol,根据反应4NH3·H2O + Cu2+ == Cu(NH3)42+ + 4H2O可知,生成Cu(NH3)42+的物质的量也为1.6755![]() 10-4 mol,则Cu(NH3)42+的浓度为
10-4 mol,则Cu(NH3)42+的浓度为![]() = 1.6755
= 1.6755![]() 10-3 mol/L,纯度为
10-3 mol/L,纯度为![]() 100% = 92.5%,
100% = 92.5%,
故答案为:92.5%。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】己知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示。下列说法正确的是

A. H2O2分解属于吸热反应
B. 加入催化剂,减小了反应的热效应
C. 加入催化剂,可提高正反应的活化能
D. 反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A与CO、H2O以物质的量1︰1︰1的比例形成B,B中的两个官能团分别具有乙烯和乙酸中官能团的性质,E是有芳香气味、不易溶于水的油状液体,有关物质的转化关系如下:
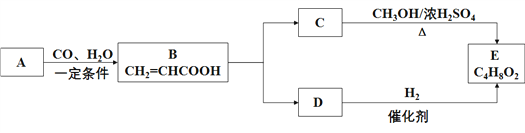
请回答:
(1)A的结构简式__________。
(2)D→E的反应类型__________。
(3)CE的化学方程式________________________________________。
(4)下列说法不正确的是__________。
A.可用金属钠鉴别B和C
B.A在一定条件下可与氯化氢发生加成反应
C.乙酸和乙醇在浓硫酸作用下加热也可生成E
D.与A的最简式相同,相对分子质量为78的烃一定不能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关常见金属的说法错误的是
A.电解饱和食盐水可以获得金属钠
B.镁因在空气中形成了一薄层致密的氧化膜,故镁不需要像钠似的进行特殊保护
C.铝罐、铁罐可以盛装冷的浓硫酸、浓硝酸
D.铁、铜都是具有可变化合价的过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学是指从技术、经济上设计可行的化学反应,尽可能减少对环境的负作用。下列 化学反应不符合绿色化学概念的是( )
A. 消除硫酸厂尾气排放:SO2+2NH3+H2O=(NH4)2SO3
B. 消除制硝酸厂的氮氧化物污染:NO2+NO+2NaOH=2NaNO2+H2O
C. 制 CuSO4:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D. 制 CuSO4:2Cu+O2![]() 2CuO,CuO+H2SO4(稀)=CuSO4+H2O
2CuO,CuO+H2SO4(稀)=CuSO4+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正在研制的一种“高容量、低成本”锂-铜空气燃料电池,该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程2Li+Cu2O+H2O=2Cu+2Li++20H-,下列说法不正确的是
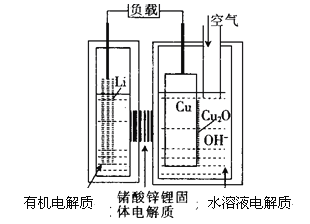
A. 放电一段时间后右侧水溶液pH升高
B. 整个反应过程中,铜相当于催化剂
C. 通空气时,铜被腐蚀,表面产生CuO
D. 放电时,正极的电极反应式为 Cu2O+H2O+2e-=Cu+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组模拟“人工树叶”电化学装置如下图所示,该装置能将H2O和CO2转化为糖类(C6H12O6)和O2,X、Y是特殊催化剂型电极,下列说法正确的是
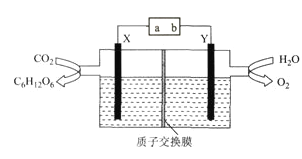
A. 电源a极为正极
B. 该装置中Y电极发生还原反应
C. X电极的电极反应式为6CO2+24H++24e-=C6H12O6+6H2O
D. 理论上,每生成22.4L(标准状况下)O2,必有4mol H+由X极区向Y极区迁移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com