
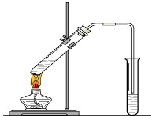
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:分析 (1)乙醇、乙酸易溶于水,导管在液面下可发生倒吸;
(2)酯化反应为可逆反应,且浓硫酸具有吸水性;
(3)饱和碳酸钠溶液可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度;
(4)酯化反应为可逆反应;
(5)乙酸与乙醇发生酯化反应生成乙酸乙酯和水.
解答 解:(1)乙醇、乙酸易溶于水,导管在液面下可发生倒吸,则导气管不能插入Na2CO3溶液中是为了防止倒吸,
故答案为:防止倒吸;
(2)酯化反应为可逆反应,且浓硫酸具有吸水性,则浓H2SO4的作用是催化剂、吸水剂,
故答案为:催化剂;吸水剂;
(3)饱和Na2CO3溶液的作用是吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度,偏于分层,然后分液可分离,
故答案为:吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度;
(4)反应中乙醇和乙酸的转化率不能达到100%,原因是酯化反应为可逆反应,反应物不能完全转化为生成物,
故答案为:酯化反应为可逆反应;
(5)乙酸与乙醇发生酯化反应生成乙酸乙酯和水,反应为CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O.
点评 本题考查有机物的制备实验,为高频考点,把握有机物的结构与性质、有机反应为解答的关键,侧重分析与实验能力的考查,注意混合物分离的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 000 mL容量瓶,58.5 g NaCl | B. | 980 mL容量瓶,57.3 g NaCl | ||
| C. | 500 mL容量瓶,58.5 gNaCl | D. | 1 000 mL容量瓶,117.0 g NaC1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
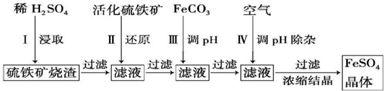
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| |温度/℃ | 700 | 800 | 900 | 1000 | 1200 |
| 平衡常数 | 0.5 | 0.6 | 1.0 | 1.6 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.08 | B. | 0.04 | C. | 0.032 | D. | 0.036 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com