
| A. | 溴水 | B. | 酸性KMnO4 | C. | 浓HNO3 | D. | CuSO4溶液 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| R | Q | ||
| M | T |
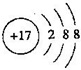 ; 元素M在元素周期表中的位置是第三周期第VIA族.
; 元素M在元素周期表中的位置是第三周期第VIA族.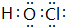 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质A的转化率大了 | B. | a<b | ||
| C. | 物质B的质量分数减小了 | D. | 平衡向正反应方向移动了 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
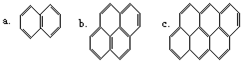 在沥青的蒸气中含有稠环芳香烃,其中一些成分可视为“同系物”,如:以此顺序推测还可以有d、e、f…等,在该系列化合物中,碳的最大百分含量是( )
在沥青的蒸气中含有稠环芳香烃,其中一些成分可视为“同系物”,如:以此顺序推测还可以有d、e、f…等,在该系列化合物中,碳的最大百分含量是( )| A. | 100% | B. | 56% | C. | 97.3% | D. | 93.8% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
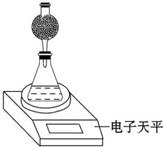 某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1 HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1 HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 2.00 | |
| ② | 1.00 | ||
| ③ | 2.00 | ||
| ④ | 2.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水中能电离出离子的化合物一定是离子化合物 | |
| B. | CO2分子中含极性键,且溶于水能导电,所以CO2是电解质 | |
| C. | Ca(OH)2微溶于水,所以是弱电解质 | |
| D. | CH3COOH在水中只能部分电离,所以是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
数据编号 | NaOH加入的体积/mL | 溶液的PH | ||
| c(HX) | c(HY) | |||
| ① | 0 | 3 | 1 | |
| ② | a | 7 | ||
| ③ | 20.00 | x | y | |
| A. | 在相同温度下,同浓度的两种酸溶液的导电能力顺序HX<HY | |
| B. | 由表中数据可估算出Ka(HY)≈10-5 | |
| C. | HY和HX混合,c(H+)=c(X-)+c(HX)+c(OH-) | |
| D. | 上述②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com